西安科技大学:《物理化学》课程教学资源(PPT课件)第五章 化学平衡 Chemical Equilibrium

西安科技大学 Xi'an Universify of Science &Techmology 第五章 化学平衡 Chemical Equilibrium
Xi’an University of Science & Technology 第五章 化学平衡

Brief introduction 主要内容: 5.1化学反应的等温方程 5.2理想气体反应的标准平衡常数 5.3温度对标准平衡常数的影响 5.4其它因数对理想气体化学平衡的影响 5.6真实气体反应的化学平衡 5.7混合物和溶液中的化学平衡
Xi’an University of Science & Technology Brief introduction 5.1 化学反应的等温方程 5.2 理想气体反应的标准平衡常数 5.3 温度对标准平衡常数的影响 5.4 其它因数对理想气体化学平衡的影响 5.7 混合物和溶液中的化学平衡 主要内容: 5.6 真实气体反应的化学平衡

化学反应的等温方程 5.1化学反应的等温方程 摩尔反应吉布斯函数与化学反应亲和势 化学反应体系:封闭的单相体系,不作非膨胀功,发 生了一个化学反应,设为: dD+eE+.>fF+gG+. 各物质的变化量必须满足: 0=∑B 根据反应进度的定义,可以得到:d5=dh→dhe=,d
Xi’an University of Science & Technology 化学反应体系:封闭的单相体系,不作非膨胀功,发 生了一个化学反应,设为: d e f g D E F G + + → + + B B 0 B = 各物质的变化量必须满足: 根据反应进度的定义,可以得到: 化学反应的等温方程 5.1 化学反应的等温方程 摩尔反应吉布斯函数与化学反应亲和势 B d B d n = d d nB B =

化学反应亲和势(affinity of chemical reaction) dG=-SdT+p+∑hdne 等温、等压条件下, (do,=∑4dn=∑4d5 (dng vads) -24 (a) 当5=1mol时: 摩尔反应 △,Gm=∑Ya4e (b) Gibbs函数 化学反应 A-△,Gm 恒温恒压、非体积功为0时 亲和势 的化学反应的推动力
Xi’an University of Science & Technology B B B d d d d G S T V p n = − + + , B B B B B B d d d ( )G n T p = = B B (d d ) n = 等温、等压条件下, , B B B ( ) (a) T p G = 当 = 1 mol 时: r m B B B 摩尔反应 = G (b) Gibbs函数 def A Gr m − 恒温恒压、非体积功为0时 的化学反应的推动力 化学反应 亲和势 化学反应亲和势(affinity of chemical reaction)

化学反应亲和势(affinity of chemical reaction) 由化学反应亲和势: 或A=-△,Gm 得出: A是状态函数,体系的强度性质。用A判断化学反应的方向 如下: A>0 反应正向进行 A<0 反应逆向进行 A=0 反应达平衡
Xi’an University of Science & Technology 化学反应亲和势(affinity of chemical reaction) def , B B B ( )T p G A − = − r m 或 A G = - A是状态函数,体系的强度性质。用A判断化学反应的方向 如下: A>0 反应正向进行 A<0 反应逆向进行 A=0 反应达平衡 由化学反应亲和势: 得出:

注意这两个公式适用条件: (1)等温、等压、不作非膨胀功的一个化学反应; (2)反应过程中,各物质的化学势4保持不变。 公式(a)表示有限体系中发生微小的变化: 公式(b)表示在大量的体系中发生了反应进度等于1mol的 变化。这时各物质的浓度基本不变,化学势也保持不变
Xi’an University of Science & Technology 注意这两个公式适用条件: (1)等温、等压、不作非膨胀功的一个化学反应; (2)反应过程中,各物质的化学势 B 保持不变。 公式(a)表示有限体系中发生微小的变化; 公式(b)表示在大量的体系中发生了反应进度等于1 mol的 变化。这时各物质的浓度基本不变,化学势也保持不变

化学反应的方向与限度 9 摩尔反应吉布斯函数与反应进度的关系,平衡条件 用,(9,工山或AG判断都是等效的 A>0 △Gm0 反应自发地向左进行,不可 能自发向右进行 A=0 △Gm=0 反应达到平衡
Xi’an University of Science & Technology 化学反应的方向与限度 r m G 0 反应自发地向左进行,不可 能自发向右进行 r m G = 0 反应达到平衡 A 0 r m A 0 G 0 反应自发地向右进行 A = 0 摩尔反应吉布斯函数与反应进度的关系,平衡条件 用 , B r m 判断都是等效的。 B ( ) , T p B G G A, 或
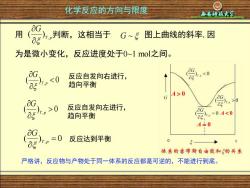
化学反应的方向与限度 用 判断, 这相当于G~5 图上曲线的斜率,因 为是微小变化,反应进度处于0~1mol之间。 0 反应自发向右进行, 0 反应自发向左进行, ,0 G 趋向平衡 ,=04<0 A+0 =0 反应达到平衡 0 体象的吉布斯自由能和的关象 严格讲,反应物与产物处于同一体系的反应都是可逆的,不能进行到底
Xi’an University of Science & Technology 用 判断,这相当于 图上曲线的斜率,因 为是微小变化,反应进度处于0~1 mol之间。 T p G , ( ) G ~ ( ) 0 , T p G 反应自发向右进行, 趋向平衡 ( ) 0 , T p G 反应自发向左进行, 趋向平衡 ( ) , = 0 T p G 反应达到平衡 A 0 A 0 A = 0 严格讲,反应物与产物处于同一体系的反应都是可逆的,不能进行到底。 化学反应的方向与限度

化学反应的等温方程 9 理想气体化学反应的等温方程 0=VBB B 4B=u°+RTn(pB/p) 将化学势表示式代入△Gm的计算式,得: A,Gn=∑YB4B B =∑ysg+∑Vr RT Ine(pB/p) B 令:△,G0=∑V哈 △,G%称为化学反应标准摩尔Gibbs自由能变化值, 只是温度的函数
Xi’an University of Science & Technology 将化学势表示式代入 r m G 的计算式,得: r m B B B G 令: = 称为化学反应标准摩尔Gibbs 自由能变化值, 只是温度的函数。 r m G 理想气体化学反应的等温方程 化学反应的等温方程 B B 0 B = ln( / ) B = + RT pB p = + = B B B B B B B r m B B RT p p G ln( / )

化学反应的等温方程 △,Gm=△,G9+∑VaRTh Pa/p) 因为:∑VaRT In(pa/p)=RT∑h(pB/p)' =RT (palpe) 令:-()→ 压力商 所以: △,Gm=△,G9+RThJ, 理想气体化学反应的等温方程
Xi’an University of Science & Technology 化学反应的等温方程 B v B P B p J p = 压力商 = + B r Gm r Gm B RT ln( pB / p ) B B RT p p RT p p RT p p B B B B B B ln ( / ) ln( / ) ln( / ) = 因为: = 令: 所以: r m r m p G = G + RT ln J 理想气体化学反应的等温方程
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 西安科技大学:《物理化学》课程教学资源(PPT课件)第四章 多组分系统热力学 Thermodynamics of Polycomponent system.ppt
- 西安科技大学:《物理化学》课程教学资源(PPT课件)第三章 热力学第二定律 The second Law of Thermodynamics.ppt
- 西安科技大学:《物理化学》课程教学资源(PPT课件)第二章 热力学第一定律 The First Law Of Thermodynamics.ppt
- 西安科技大学:《物理化学》课程教学资源(PPT课件)第一章 气体的pVT关系 The Properties of Gases(主讲:刘向荣).ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第12章 胶体化学.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第11章 化学动力学.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第9章 统计热力学基础.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第7章 电化学.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第6章 相平衡.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第5章 化学平衡.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第3章 热力学第二定律.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第2章 热力学第一定律.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)第1章 气体的PVT关系.ppt
- 华南理工大学:《物理化学》课程电子教案(PPT教学课件)绪论.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十四章 细胞代谢和基因表达的调控.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十三章 核酸与蛋白质的生物合成及基因工程.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十二章 核酸的降解和核苷酸代谢.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十一章 蛋白质降解及氨基酸代谢.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十章 脂类代谢.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第九章 糖代谢.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第一章 蛋白质结构与功能.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第二章 核酸的结构和功能.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第三章 酶学.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第四章 三羧酸循环和能量代谢.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第五章 糖代谢.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第六章 脂类代谢.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第七章 蛋白质代谢.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第八章 非营养物质的代谢.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第九章 水盐代谢.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第十章 酸碱平衡.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第十一章 基因信息的储存和表达.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(PPT讲稿)第十二章 细胞间信息传递——信号传导.ppt
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(试卷习题)综合测试卷1(无答案).doc
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(试卷习题)综合测试卷2(无答案).doc
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(试卷习题)综合测试卷3(无答案).doc
- 上海健康医学院(上海医药高等专科学校):《生物化学》课程教学课件(试卷习题)综合测试卷4(无答案).doc
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第一章 绪论.ppt
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第三章 烯烃和二烯烃.ppt
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第四章 炔烃.ppt
- 石家庄职业技术学院:《有机化学》课程教学资源(PPT课件)第五章 脂环烃.ppt
