《化学学科教学论》课程教学资源(教案讲义)钠及其化合物

第一节钠 教学目标: 1、通过学生的实验探究,掌握Na2CO3和NaHCO3的基本性质 2、通过学生的实验探究,堂握F©2+的还原性和F©3+的氧化性以及它们的检验方法 3.、通过学生的讨论,掌提Na2CO3与NaHCO3以及Fe2+与Fe3+的相互转化关系 4、进一步巩固离子反应方程式的书写和对氧化还原反应理论的理解 教学重点:1、Na2CO3与NaHCO3的相互转化关系 2、F2+的还原性和Fe3+的氧化性以及它们的检险方法 教学难点:Na2CO3与NaHCO3以及Fe2+与Fe3+的相互转化关系 教学方法:学生实验探究法,学习小组讨论、交流 引入:新闻一一水雷频炸珠江水柱冲天有惊无险 试问:水可灭火也可纵火? 经调查该水雷是金属钠,金属钠到底是一种怎样的物质?它有哪些性质呢?今天我们就 来学习它。我们经常讲结构决定性质。我们来看一下钠的结构。 ①2 钠Na 决定〉还原性 钠在金属活动性顺序表中的位置: K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb(佃)、Cu、Hg、Ag、Pt、Au 推测它的化学性质?如何证明? 一应该比较活泼 一用实验来证明。 实验一:钠和水反应 操作:向一只盛有水的小烧杯中滴加几滴酚酞试液,然后将一小块金属钠投入小烧杯中, 观察实验现象。 一、物理性质 状态 颜色 硬度 密度 熔点 固体 银白色 较软 比煤油重,比水轻 低 二、化学性质 实验现象与结论 浮 一密度小于水 熔 一反应放热、钠熔点低 -有气体产生 红 一有碱性物质生成
1 第一节 钠 教学目标: 1、通过学生的实验探究,掌握 Na2CO3 和 NaHCO3 的基本性质 2、通过学生的实验探究,掌握 Fe2+的还原性和 Fe3+的氧化性以及它们的检验方法 3、通过学生的讨论,掌握 Na2CO3 与 NaHCO3 以及 Fe2+与 Fe3+的相互转化关系 4、进一步巩固离子反应方程式的书写和对氧化还原反应理论的理解 教学重点:1、Na2CO3 与 NaHCO3 的相互转化关系 2、Fe2+的还原性和 Fe3+的氧化性以及它们的检验方法 教学难点:Na2CO3 与 NaHCO3 以及 Fe2+与 Fe3+的相互转化关系 教学方法:学生实验探究法,学习小组讨论、交流 引入:新闻——水雷频炸珠江 水柱冲天 有惊无险 试问:水可灭火 也可纵火? 经调查该水雷是金属钠,金属钠到底是一种怎样的物质?它有哪些性质呢? 今天我们就 来学习它。我们经常讲结构决定性质。我们来看一下钠的结构。 钠 Na ⎯决定⎯→ 还原性 钠在金属活动性顺序表中的位置: K、Ca、Na、 Mg、Al、Zn、Fe、Sn、Pb(H)、Cu、Hg、Ag、Pt、Au 推测它的化学性质?如何证明? ——应该比较活泼,——用实验来证明。 实验一:钠和水反应 操作:向一只盛有水的小烧杯中滴加几滴酚酞试液,然后将一小块金属钠投入小烧杯中, 观察实验现象。 一、物理性质 状态 颜色 硬度 密度 熔点 固体 银白色 较软 比煤油重,比水轻 低 二、化学性质 实验现象与结论 浮——密度小于水 熔——反应放热、钠熔点低 游——有气体产生 红——有碱性物质生成

1、与水反应 2Na+2H,0→2Na0H+H2↑(浮、游、熔、红) 拓展应用: (1)金属之间存在以强制弱原则,钠比铜活泼,能否从硫酸铜溶液中置换出单质铜?为 什么? 己知Cu2+在水中如图?(见PPT 2Na+2H0→2Na0H+H1 CuS0,+2Na0H→Cu(OH)z↓+Na2S0, 总反应:2Na+2H,0+CuS0,→NaS0,+Cu(0H):↓+H↑ 实质是:钠先与水反应生成氢氧化钠,氢氧化钠再与盐反应。 同理思考:钠投入氯化铁溶液中。 (2)把钠投入盐酸中,如何反应? 先与酸反应,过量后再与水反应 2Na+2H-2Na++H2 t 2、与氧气反应 实验二:钠和氧气反应 4Na+02→2Na0(白色固体) 现象:切开的金属钠在空气中很快变暗 2Na+0,点槛)Na,0,(淡黄色固体) 现象:钠在空气中燃烧,发出黄色火焰,生成淡黄色固体。 注:Na0一一不是碱性氧化物,是过氧化物。 思考:Na0和Na0,哪个更稳定? 2Na,0+02 4→2Naz0 3、与其他非金属反应 实验三:钠在氯气中燃烧 2Na+C1,蓝→2NaC1 现象:剧烈燃烧,产生大量白烟 实验四:钠和硫研磨 2Na+S开→NaeS 现象:反应剧烈,甚至发生爆炸 其他:钠和氢气反应 2Na+H→2NaH 2
2 1、与水反应 2Na + 2H2O→2NaOH + H2↑(浮、游、熔、红) 拓展应用: (1)金属之间存在以强制弱原则,钠比铜活泼,能否从硫酸铜溶液中置换出单质铜?为 什么? 已知Cu2+在水中如图?(见PPT) 2Na + 2H2O →2NaOH + H2↑ CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4 总反应:2Na+2H2O+CuSO4→Na2SO4 +Cu(OH)2↓+H2↑ 实质是:钠先与水反应生成氢氧化钠,氢氧化钠再与盐反应。 同理思考:钠投入氯化铁溶液中。 (2)把钠投入盐酸中,如何反应? 先与酸反应,过量后再与水反应 2Na+2H+→2Na++H2↑ 2、与氧气反应 实验二:钠和氧气反应 4Na + O2→2Na2O(白色固体) 现象:切开的金属钠在空气中很快变暗 2Na + O2 ⎯点燃⎯→ Na2O2(淡黄色固体) 现象:钠在空气中燃烧,发出黄色火焰,生成淡黄色固体。 注:Na2O2——不是碱性氧化物,是过氧化物。 思考:Na2O 和 Na2O2 哪个更稳定? 2Na2O+O2 ⎯⎯→ 2Na2O2 3、与其他非金属反应 实验三:钠在氯气中燃烧 2Na + Cl2 ⎯点燃⎯→ 2NaCl 现象:剧烈燃烧,产生大量白烟 实验四:钠和硫研磨 2Na + S ⎯研磨⎯→ Na2S 现象:反应剧烈,甚至发生爆炸 其他:钠和氢气反应 2Na+H2→2NaH

三、用途(性质决定用途) 1、制取钠的化合物一一如Na0,→化学性质很活泼: 2、还原多种稀有金属一化学性质很活泼 如:4Na+TiCl, 700-800℃ Ti 4NaCl 3、钠、钾合金可作原子反应堆的导热剂→Na、K合金导热性能好: 4、制作电光源一一高压钠灯一黄光透雾能力强、射程远 四、存在与制备 钠元素在自然界中有没有游离态? 以化合态存在:如氯化钠、硫酸钠、碳酸钠、硝酸钠等。 制备:2NaC1(熔融)邂→2Na+CLzt 思考:1、钠为何要保存在煤油中? 2、钠着火怎么办?一一用黄沙 3、钠如果放置在空气中如何变质?最终产物是什么? 解析:银白色的金属钠→变暗(生成NaO)→变白色固体(生成NaOH)→成液滴(NaOH 潮解)→晶体(吸收C02成Na,C0,·10H0)一最后变成白色粉末(风化,变为NazC0 发生上述现象的有关化学方程式为: 4Na+0,→2Na,0 Na,0+H0-→2Na0l 2Na0H+C02→NazC0s+H0 NaC0,+10H,0→Na:C0,·10H20 NaC0,·10H0→NaC0+10H0(风化) 4、将0.2mol钠放入500ml0.2mol/L盐酸中,生成氢气在标况下的体积为多少升? 5、将4.6g钠放入95.4g水中,所得溶液的质量分数是多少? 第二节钠的化合物
3 三、用途 (性质决定用途) 1、 制取钠的化合物——如 Na2O2→化学性质很活泼; 2、还原多种稀有金属→化学性质很活泼 如:4Na + TiCl4 Ti + 4NaCl 3、钠、钾合金可作原子反应堆的导热剂→Na、K 合金导热性能好; 4、制作电光源——高压钠灯→黄光透雾能力强、射程远 四、存在与制备 钠元素在自然界中有没有游离态? 以化合态存在:如氯化钠、硫酸钠、碳酸钠、硝酸钠等。 制备:2NaCl(熔融) ⎯电解⎯→ 2Na + Cl2↑ 思考:1、钠为何要保存在煤油中? 2、钠着火怎么办? ——用黄沙 3、钠如果放置在空气中如何变质?最终产物是什么? 解析:银白色的金属钠→变暗(生成 Na2O)→变白色固体(生成 NaOH)→成液滴(NaOH 潮解)→晶体(吸收 CO2成 Na2CO3·10H2O)→最后变成白色粉末(风化,变为 Na2CO3) 发生上述现象的有关化学方程式为: 4Na+O2→2Na2O Na2O+H2O→2NaOH 2NaOH+CO2→Na2CO3+H2O Na2CO3+10H2O→Na2CO3·10H2O Na2CO3·10H2O→Na2CO3+10H2O(风化) 4、将 0.2mol 钠放入500ml 0.2mol/L 盐酸中,生成氢气在标况下的体积为多少升? 5、将 4.6g 钠放入 95.4g 水中,所得溶液的质量分数是多少? 第二节 钠的化合物 700-800℃
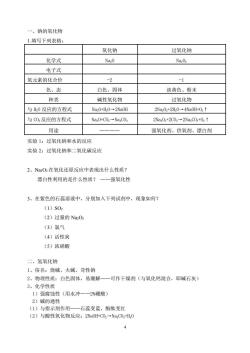
一、钠的氧化物 1.填写下列表格: 氧化钠 过氧化钠 化学式 Na-0 电子式 氧元素的化合价 -2 -1 色、态 白色、固体 淡黄色、粉末 种类 碱性氧化物 过氧化物 与H0反应的方程式 Na.0+H,0→2Na0H 2Na:02+2Hz0-4Wa0H+02↑ 与C02反应的方程式 Na0+C0,→NazC0, 2Naz02+2C02→2NaC0,+021 用途 强氧化剂、供氧剂、漂白剂 实验1:过氧化钠和水的反应 实验2:过氧化钠和二氧化碳反应 2、NaO2在氧化还原反应中表现出什么性质? 漂白性利用的是什么性质?一一强氧化性 3、在紫色的石蕊溶液中,分别加入下列试剂中,现象如何? (1)S02 (2)过量的NaO2 (3)氯气 (4)活性炭 (5)浓硝酸 二、氢氧化钠 1、俗名:烧碱、火碱、苛性钠 2、物理性质:白色固体,易潮解一一可作干燥剂(与氧化钙混合,即碱石灰) 3、化学性质 1)强腐蚀性(用水冲一一2%硼酸) 2)碱的通性 (1)与指示剂作用一一石蕊变蓝,酚酞变红 (2)与酸性氧化物反应:2Na0H+00,一Na00,+H,0
4 一、钠的氧化物 1.填写下列表格: 氧化钠 过氧化钠 化学式 Na2O Na2O2 电子式 氧元素的化合价 -2 -1 色、态 白色、固体 淡黄色、粉末 种类 碱性氧化物 过氧化物 与 H2O 反应的方程式 Na2O+H2O→2NaOH 2Na2O2+2H2O→4NaOH+O2↑ 与 CO2 反应的方程式 Na2O+CO2→Na2CO3 2Na2O2+2CO2→2Na2CO3+O2↑ 用途 ———— 强氧化剂、供氧剂、漂白剂 实验 1:过氧化钠和水的反应 实验 2:过氧化钠和二氧化碳反应 2、Na2O2 在氧化还原反应中表现出什么性质? 漂白性利用的是什么性质? ——强氧化性 3、在紫色的石蕊溶液中,分别加入下列试剂中,现象如何? (1)SO2 (2)过量的 Na2O2 (3)氯气 (4)活性炭 (5)浓硝酸 二、氢氧化钠 1、俗名:烧碱、火碱、苛性钠 2、物理性质:白色固体,易潮解——可作干燥剂(与氧化钙混合,即碱石灰) 3、化学性质 1)强腐蚀性(用水冲——2%硼酸) 2)碱的通性 (1)与指示剂作用——石蕊变蓝,酚酞变红 (2)与酸性氧化物反应:2NaOH+CO2→Na2CO3+H2O

Na0H+Co2→NaHC0, (3)与酸反应 (4)与某些盐反应 NaOH+NaHCO,-NazCO,+H2O 2Na0H+Ca(HC0)2→CaC0,↓+Na00+2H0 NaOH+Ca (HCO,),-CaCo,+NaHCO,+H,0 4、保存 塑料瓶中,短期可保存在玻璃瓶中,但不用磨口玻璃塞,应用橡皮塞或木塞。 三、氯化钠 氯碱工业:电解饱和食盐水 2NaC1+2H0电→C12↑+H2↑+2Na0H 现象:两极都有气泡 检验:阳极一一C1z:湿润的KI淀粉试纸变蓝 阴极一一H2:爆鸣 阴极附近 一NaOH:酚酞变红 电极反应:阳极2C1-2e→C121 阴极2H+2e→H1 四、碳酸盐 引入:碳酸钠的用途 制玻璃纤维、玻璃制品、造纸、制皂、合成洗涤剂、纺织 根据初中所学知识,NaC0,能与什么物质反应?写出反应式? 碳酸钠的化学性质小结 1.与酸反应 2.与某些碱反应:Ca(OH)2、Ba(O2 3.与某些盐反应:CaCl2、BaCl2 练习:写出Na,C0与C0、Ba(O)、BaCl2反应方程式 过渡:NazCO.与NaHCO.3都是盐,那么它们的性质相似吗? 分析:构成粒子:NaCO:Na、C0 NaHC0a:Na、HC03 二、碳酸钠、碳酸氢钠性质比较 NaHCO 俗称 纯减、苏打
5 NaOH+CO2→NaHCO3 (3)与酸反应 (4)与某些盐反应 NaOH+NaHCO3→Na2CO3+H2O 2NaOH+Ca(HCO3)2→CaCO3↓+Na2CO3+2H2O NaOH+Ca(HCO3)2→CaCO3↓+NaHCO3+H2O 4、保存 塑料瓶中,短期可保存在玻璃瓶中,但不用磨口玻璃塞,应用橡皮塞或木塞。 三、氯化钠 氯碱工业:电解饱和食盐水 2NaCl+2H2O ⎯电解⎯→ Cl2↑+H2↑+2NaOH 现象:两极都有气泡 检验:阳极——Cl2:湿润的 KI 淀粉试纸变蓝 阴极——H2:爆鸣 阴极附近——NaOH:酚酞变红 电极反应:阳极 2Cl- -2e→Cl2↑ 阴极 2H+ +2e→H2↑ 四、碳酸盐 引入:碳酸钠的用途 制玻璃纤维、玻璃制品、造纸、制皂、合成洗涤剂、纺织 根据初中所学知识,Na2CO3能与什么物质反应?写出反应式? 一、碳酸钠的化学性质小结 1.与酸反应 2.与某些碱反应:Ca(OH)2、 Ba(OH)2 3.与某些盐反应:CaCl2、BaCl2 练习:写出 Na2CO3与 CO2 、 Ba(OH)2 、BaCl2反应方程式 过渡:Na2CO3与 NaHCO3都是盐,那么它们的性质相似吗? 分析:构成粒子:Na2CO3:Na+、CO3 2- NaHCO3:Na+、HCO3 - 二、碳酸钠、碳酸氢钠性质比较 Na2CO3 NaHCO3 俗称 纯碱、苏打 小苏打

色、态 白色粉末 白色晶体 水溶性 易溶 可溶 溶液的酸碱性 碱性,相同浓度:NaCO,>NaHCO, 热稳定饵 稳定 2NaHCO,- a)NaC01+H20tC0,↑ 与盐酸反应 Na,C0,+2HC1→2NaC1+H0+C02↑ NaHCO,.+HC1→NaC1+Hl0+C0,↑ 与NaOH溶液反应 NaHCO,+NaOH-NazCO,+H.O 与C0反应 NazCO,+CO2 t+H20-2NaHCO 用途 制玻璃、肥皂、造纸、纺织等 发酵粉、胃药、灭火器等 实验1:碳酸钠、碳酸氢钠热稳定性比较 实验2:碳酸钠、碳酸氢钠分别与盐酸反应 现象分析:碳酸氢钠与盐酸反应产生气体速度快。 H(一步) C02 H H2C03 HCO3 (C02+H20) 2H' (两步) NazCO+HC1 -NaHCO,+NaCl +NaHCO,+HC1-NaCl CO.+H.O NazCO,2HCI-2NaCl CO2 H20 [思考]:把HCl滴加到盛有NaCO,溶液的试管中。或把NaCO溶液滴加到盛有稀HCl溶液 的试管中。思考现象是否相同?为什么? 现象:前者刚滴入时无气体产生,后增多!后者滴入进,马上产生较多的气体! [结论]:可用互滴实验鉴别Na,CO,和HC1溶液 三、碳酸钠和碳酸氢钠鉴别及相互转化 讲义:分析以下五种区别碳酸钠和碳酸氢钠的实验的优劣。 方法1:用等量的水溶解碳酸钠和碳酸氢钠固体,能溶解较多的是碳酸钠。 方法2:将氯化钙溶液分别加入碳酸钠和碳酸氢钠溶液中,能产生浑浊的是碳酸钠。 方法3:用PH试纸检验饱和碳酸钠和碳酸氨钠溶液的酸藏性,碱性较强的是碳酸钠, 方法4:将碳酸钠和碳酸氢钠固体分别置于试管中进行加热,能发生分解,试管上部 有水气凝结且生成能使澄清石灰水产生浑浊的气体的是碳酸氢钠。 方法5:将等质量碳酸钠和碳酸氢钠固体分别置于具支试管中,试管口塞上带滴液漏 斗(装有等量等浓度的稀盐酸)的橡皮塞,支管口套上气球,将稀盐酸同时滴入试管,小 气球膨胀更快、更大的是碳酸氢钠。 总结两者的鉴别:若为固体一一加热 6
6 色、态 白色粉末 白色晶体 水溶性 易溶 可溶 溶液的酸碱性 碱性, 相同浓度:Na2CO3 >NaHCO3 热稳定性 稳定 2NaHCO3 ⎯⎯→ Na2CO3+H2O+CO2↑ 与盐酸反应 Na2CO3+2HCl→2NaCl+H2O+CO2↑ NaHCO3+HCl→NaCl+H2O+CO2↑ 与 NaOH 溶液反应 — NaHCO3+NaOH→Na2CO3+H2O 与 CO2 反应 Na2CO3+ CO2↑+H2O→2NaHCO3 — 用途 制玻璃、肥皂、造纸、纺织等 发酵粉、胃药、灭火器等 实验 1:碳酸钠、碳酸氢钠热稳定性比较 实验 2:碳酸钠、碳酸氢钠分别与盐酸反应 现象分析:碳酸氢钠与盐酸反应产生气体速度快。 Na2CO3 + HCl →NaHCO3 +NaCl +) NaHCO3 + HCl→NaCl + CO2 + H2O Na2CO3 + 2HCl → 2NaCl + CO2 + H2O [思考]:把 HCl 滴加到盛有 Na2CO3 溶液的试管中。或把 Na2CO3 溶液滴加到盛有稀 HCl 溶液 的试管中。思考现象是否相同?为什么? 现象:前者刚滴入时无气体产生,后增多! 后者滴入进,马上产生较多的气体! [结论]:可用互滴实验鉴别 Na2CO3 和 HCl 溶液 三、碳酸钠和碳酸氢钠鉴别及相互转化 讲义:分析以下五种区别碳酸钠和碳酸氢钠的实验的优劣。 方法 1:用等量的水溶解碳酸钠和碳酸氢钠固体,能溶解较多的是碳酸钠。 方法 2:将氯化钙溶液分别加入碳酸钠和碳酸氢钠溶液中,能产生浑浊的是碳酸钠。 方法 3:用 PH 试纸检验饱和碳酸钠和碳酸氢钠溶液的酸碱性,碱性较强的是碳酸钠。 方法 4:将碳酸钠和碳酸氢钠固体分别置于试管中进行加热,能发生分解,试管上部 有水气凝结且生成能使澄清石灰水产生浑浊的气体的是碳酸氢钠。 方法 5:将等质量碳酸钠和碳酸氢钠固体分别置于具支试管中,试管口塞上带滴液漏 斗(装有等量等浓度的稀盐酸)的橡皮塞,支管口套上气球,将稀盐酸同时滴入试管,小 气球膨胀更快、更大的是碳酸氢钠。 总结两者的鉴别:若为固体——加热 CO3 2- HCO3 - H2CO3 (CO2+H2O) H + 2 H+ (两步) H + (一步)

若为溶液一一CaClz、BaCl2溶液,不能用氢氧化钙或氢氧化钡溶液。 相互转化: 通入C02 Na,COa NaHCO △或加NaOH (1)注意固态、溶液两种情况下酸式盐变为正盐的方法。写出化学方程式: 固体:2NaHC0,→Na,C0,+H,0+C02↑ 溶液:NaHC0+NaOH→NaCO+H0 (2)碳酸钠溶液转化为碳酸氢钠溶液:向碳酸钠溶液中通入二氧化碳可以生成碳酸氢钠: Na-CO+COz t +H20-2NaHCO 思考:除杂 Na-CO.(NaHCO,)固体:加热:溶液:NaOH(适量) NaHCO,(NaCO,) 通入C0(0) 随堂练习: 1、Ba(OH2与NaHC0,反应时,离子方程式 (1)BaOH)2过量时: (2)NaHC0过量时: 2.在一定温度下,将足量的二氧化碳通入饱和的下列溶液有何现象?写出有关的反应方 程式。 (1)NaC0溶液 (2)NaOH溶液 (3)CaC,溶液 (4)澄清石灰水 3、将足量的C02通入到装有饱和的NC0,溶液的试管中将会观察到有何现象?为什么? 现象:溶液变浑浊,静置后析出白色晶体! 原因:①相同温度:S碳酸钠>S碳酸氢钠②有水参加反应 ③生成碳酸氢钠的质量大于碳酸钠的质量 纯碱工业制法 1、廉价原料:食盐、石灰石
7 若为溶液——CaCl2、BaCl2 溶液,不能用氢氧化钙或氢氧化钡溶液。 相互转化: (1)注意固态、溶液两种情况下酸式盐变为正盐的方法。写出化学方程式: 固体:2NaHCO3 ⎯⎯→ Na2CO3+H2O+CO2↑ 溶液:NaHCO3+NaOH→Na2CO3+H2O (2)碳酸钠溶液转化为碳酸氢钠溶液:向碳酸钠溶液中通入二氧化碳可以生成碳酸氢钠: Na2CO3+ CO2↑+H2O→2NaHCO3 思考:除杂 Na2CO3 (NaHCO3) 固体:加热 ; 溶液:NaOH(适量) NaHCO3(Na2CO3) 通入 CO2(H2O) 随堂练习: 1、Ba(OH)2 与 NaHC03 反应时,离子方程式 (1) Ba(OH)2 过量时: (2) NaHC03 过量时: 2.在一定温度下,将足量的二氧化碳通入饱和的下列溶液有何现象?写出有关的反应方 程式。 (1)Na2C03 溶液 (2)NaOH 溶液 (3)CaCl2 溶液 (4)澄清石灰水 3、将足量的 CO2 通入到装有饱和的 Na2CO3 溶液的试管中将会观察到有何现象?为什么? 现象:溶液变浑浊,静置后析出白色晶体! 原因:①相同温度:S 碳酸钠>S 碳酸氢钠 ②有水参加反应 ③生成碳酸氢钠的质量大于碳酸钠的质量 纯碱工业制法 1、 廉价原料:食盐、石灰石 通入CO2 △或加NaOH Na2CO3 NaHCO3

2、如何制纯碱 中间产物:NaHCO,A→Na,C0,Na'+HC0,-→NaHC0, 3、氨碱法(苏尔维制碱法) 饱和食盐水中通入足量NH,然后在加压下通C0z,将析出的NaHCO,.煅烧。 NH,tCO,+H,O◆NH HCO2 NH,HCO,+NaC1→NaHCO,+NH,C 2aHC0,→Na,C0,+C02↑+H0 注:NH的来源:2NH,C1+Ca(OHm2→CaCl2+2NH↑+2H0 Ca(OHD),来源:CaC0,a→Ca0+C02↑Ca0+H0→Ca(O), C0,的来源:Ca00A)Ca0+00,↑2NaH00,整Na:C0,+C0.↑+H0 优点:(1)原料(食盐、石灰石)便宜 缺点:(1)生成无用的CaCl2 (2)食盐的利用率低,只有70%,30%随CaClz溶液一起被抛弃。 4、侯氏制碱法(联合制碱法) (1)从NH,C1、NaC1的母液中提取NH,C 一降温结晶法 使H,C结晶出来,制氮肥,NaCl溶液循环使用, 不产生CaCl2。 (2)那所需的NH从哪儿来?C0,呢? 合成氨厂供应,C0也由合成氨产供给。 10200w0 图47NH,d和NaC的幕解度由线 因为合成氨所需要的原料氢气是从水煤气种制取 C+H04→C0+H2 C0+H,0△→C0,+H C0,在合成氨厂作废气处理,恰好用来制碱厂的原料。 优点:(1)母液循环使用,大大提高食盐利用率 (2)可生产出NH,C1,无CaC1:(无用)产生。 (3)联合生产的优越性,利用一个厂的废料,作为另一厂的原料。 习题 一、填空题
8 2、 如何制纯碱 中间产物:NaHCO3 ⎯⎯→ Na2CO3 Na+ +HCO3 -→NaHCO3↓ 3、 氨碱法(苏尔维制碱法) 饱和食盐水中通入足量 NH3,然后在加压下通 CO2,将析出的 NaHCO3 煅烧。 NH3+CO2+H2O→NH4HCO3 NH4HCO3+NaCl→NaHCO3↓+NH4Cl 2NaHCO3 ⎯煅烧⎯→ Na2CO3+CO2↑+H2O 注:NH3 的来源:2NH4Cl+Ca(OH)2→CaCl2+2NH3↑+2H2O Ca(OH)2 来源:CaCO3 ⎯⎯→ CaO+CO2↑ CaO+H2O→Ca(OH)2 CO2 的来源:CaCO3 ⎯⎯→ CaO+CO2↑ 2NaHCO3 ⎯煅烧⎯→ Na2CO3+CO2↑+H2O 优点:(1)原料(食盐、石灰石)便宜 缺点:(1)生成无用的 CaCl2 (2)食盐的利用率低,只有 70%,30%随 CaCl2 溶液一起被抛弃。 4、侯氏制碱法(联合制碱法) (1)从 NH4Cl、NaCl 的母液中提取 NH4Cl ——降温结晶法 使 NH4Cl 结晶出来,制氮肥,NaCl 溶液循环使用, 不产生 CaCl2。 (2)那所需的 NH3 从哪儿来?CO2 呢? 合成氨厂供应,CO2 也由合成氨产供给。 因为合成氨所需要的原料氢气是从水煤气种制取。 C+H2O ⎯⎯→ CO+H2 CO+H2O ⎯⎯→ CO2+H2 CO2 在合成氨厂作废气处理,恰好用来制碱厂的原料。 优点:(1)母液循环使用,大大提高食盐利用率, (2)可生产出 NH4Cl,无 CaCl2(无用)产生。 (3)联合生产的优越性,利用一个厂的废料,作为另一厂的原料。 习题 一、填空题

1,钠在自然界里不能以态存在,只能以态存在,这是因为 2.由于钠很容易与空气中的 等物质反应,通常将钠保存在 里,以使钠与 等隔绝 3.钠可以把钛、锆等金属从它们的卤化物中还原出来,这是由于钠具有 性。 4.(1)在空气中加热一小块钠: (②)在盛有水的烧杯中滴入几滴酚酞试液,再投入一小块钠。填写下表: 主要实验现象对实验现象的分析及有关反应的化学方程式 2) 二、在下列叙述中,错误的 A.钠燃烧时发出黄色的火焰B.钠在空气中燃烧生成氧化钠 C.钠与硫化合时可以发生爆炸D.钠是强还原剂 三、写出下列反应的化学方程式,标出电子转移的方向和数目,并指出氧 化剂和还原剂。 1.钠在空气中燃烧 2.钠与水反应 四、问答题 1.为什么不能直接用手拿金属钠? 2.能否把钠保存在汽油里或四氯化碳(CC1)中?说明理由。 (提示:汽油易挥发、易燃:0CL,的密度比a的大 五、4.6g阳与足量的0反应,计算生成的气体在标准状况下的体积(标 准状况下的密度为0.0899g/L)。 9
9 1.钠在自然界里不能以_态存在,只能以_态存在,这是因为 _。 2.由于钠很容易与空气中的_、_等物质反应,通常将钠保存在 _里,以使钠与_、_等隔绝。 3.钠可以把钛、锆等金属从它们的卤化物中还原出来,这是由于钠具有 _性。 4.(1)在空气中加热一小块钠; (2)在盛有水的烧杯中滴入几滴酚酞试液,再投入一小块钠。填写下表: 二、在下列叙述中,错误的 是 [ ] A.钠燃烧时发出黄色的火焰 B.钠在空气中燃烧生成氧化钠 C.钠与硫化合时可以发生爆炸 D.钠是强还原剂 三、写出下列反应的化学方程式,标出电子转移的方向和数目,并指出氧 化剂和还原剂。 1.钠在空气中燃烧 2.钠与水反应 四、问答题 1.为什么不能直接用手拿金属钠? 2.能否把钠保存在汽油里或四氯化碳(CCl4)中?说明理由。 (提示:汽油易挥发、易燃;CCl4的密度比 Na 的大) 五、4.6g Na 与足量的 H2O 反应,计算生成的气体在标准状况下的体积(标 准状况下 H2的密度为 0.0899g/L)
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《化学学科教学论》课程教学资源(教案讲义)从海水中获得的化学物质(溴、碘的提取).doc
- 《化学学科教学论》课程教学资源(教案讲义)卤族元素教学设计——教学设计(二).doc
- 《化学学科教学论》课程教学资源(教案讲义)卤族元素(一).doc
- 《化学学科教学论》课程教学资源(教案讲义)富集在海水中的元素——氯.doc
- 石河子大学:《化学学科教学论》课程教学资源(试题库)2012-2013期末(试题).doc
- 石河子大学:《化学学科教学论》课程教学资源(试题库)2012-2013期末(答案).doc
- 石河子大学:《化学学科教学论》课程教学资源(试题库)2011-2012期末(答案).doc
- 石河子大学:《化学学科教学论》课程教学资源(试题库)2010-2011期末(答案).doc
- 石河子大学:《化学学科教学论》课程教学资源(试题库)2009-2010期末(试题).doc
- 石河子大学:《化学学科教学论》课程教学资源(试题库)2009-2010期末(答案).doc
- 石河子大学:《化学学科教学论》课程教学资源(试题库)2011-2012期末(试题).doc
- 石河子大学:《化学学科教学论》课程教学资源(试题库)2010-2011期末(试题).doc
- 石河子大学:《化学学科教学论》课程授课(2014,任课教师:高敬芝).doc
- 《化学学科教学论》课程教学大纲 Theory of Chemistry Education.doc
- 石河子大学:《化学学科教学论》课程授课教案(2015).doc
- 《生物化学》课程教学课件(PPT讲稿)第二章 糖和糖生物化学.ppt
- 《生物化学》课程教学课件(PPT讲稿)第一章 绪论——发展中的生物化学.ppt
- 《生物化学》课程教学课件(PPT讲稿)第三章 脂生物化学 Lipid Biochemistry.ppt
- 《生物化学》课程教学课件(PPT讲稿)第四章 氨基酸(amino acid).ppt
- 《生物化学》课程教学课件(PPT讲稿)第六章 蛋白质的三维结构(1/2).ppt
- 《化学学科教学论》课程教学资源(教案讲义)金属的化学性质.doc
- 《化学学科教学论》课程教学资源(教案讲义)碱金属元素——教学设计.doc
- 《化学学科教学论》课程教学资源(教案讲义)物质的变化和性质.doc
- 《化学学科教学论》课程教学资源(教案讲义)碱金属.doc
- 《化学学科教学论》课程教学资源(教案讲义)碱金属复习总结.doc
- 《化学学科教学论》课程教学资源(教案讲义)碱金属的复习课.doc
- 《化学学科教学论》课程教学资源(教案讲义)碱金属元素(一).doc
- 《化学学科教学论》课程教学资源(教案讲义)碱金属元素(二).doc
- 《化学学科教学论》课程教学资源(教案讲义)碱金属元素(三).doc
- 《化学学科教学论》课程教学资源(教案讲义)卤素单质的制备、加碘盐中碘酸盐的鉴别和含量测定.doc
- 《化学学科教学论》课程教学资源(教案讲义)卤族元素——教学设计(一).doc
- 《化学学科教学论》课程教学资源(教案讲义)卤素性质教案.doc
- 《化学学科教学论》课程教学资源(教案讲义)卤族元素备课教案.doc
- 《化学学科教学论》课程教学资源(教案讲义)二氧化硫与三氧化硫——教学设计.doc
- 《化学学科教学论》课程教学资源(教案讲义)硫酸教案.doc
- 《化学学科教学论》课程教学资源(教案讲义)氧气教案.doc
- 《化学学科教学论》课程教学资源(教案讲义)硫·教案.doc
- 《化学学科教学论》课程教学资源(教案讲义)二氧化硫和三氧化硫.doc
- 《化学学科教学论》课程教学资源(教案讲义)卤族元素——教学设计(三).doc
- 《化学学科教学论》课程教学资源(教案讲义)元素化合物知识专题复习(PPT)卤族元素.ppt
