山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第七章 氧化还原反应
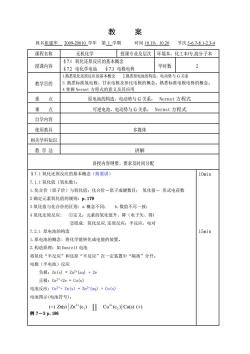
教 案 姓名崔建华2009-20010学年第1学期 时间1019,1020 节次5-67-8.1-23-4 课程名称 无机化学 授课专业及层次环境本,化工本传高分子本 §7.1氧化还原反应的基本概念 授课内容 §72电化学电池§73电极电势 学时数 2 1熟悉氧化还原反应的基本概念2熟悉原电池的构造,电动势与G关系 教学目的 3熟悉标准氢电极、甘汞电极及参比电极的概念。熟悉标准电极电势的概念 掌握Nernst方程式的意义及其应用 重点 原电池的构造,电动势与G关系,Nernst方程式 难点 可逆电池,电动势与G关系,Nernst方程式 自学内容 使用教具 多媒体 相关学科知识 教学法 讲解 讲授内容纲要、要求及时间分配 §7.1氧化还原反应的基本概念(简要讲) 10min 7.1.1氧化值(氧化数): 1.化合价(原子价)与氧化值:化合价一原子成键数目:氧化值一形式电荷数 2确定元素氧化值的规则:p.179 3氧化值与化合价的区别:a.概念不同:b.数值不尽一致: 4氧化还原反应:①定义:元素的氧化值升、降(电子失、得) ②组成:氧化反应,还原反应:半反应,电对 7.2.1原申池的构造 15min 1.原电池的概念:将化学能转化成电能的装置。 2.构造原理:如Daniell电池 将氧化“半反应”和还原“半反应”在一定装置中“隔离”分开。 电极(半电池)反应 负极:Zn(s)=Zn2(aq)+2e 正极:Cu2*+2e=Cu(s) 电池反应:C2*+Zn(s)=Zm2*(aq)+Cu(s) 电池图示(电池符号): ()Zn(s)Zn2(c)Cu"(c2)Cu(s)(+ 例7-3p.186
教 案 姓名崔建华 2009-20010 学年 第 1 学期 时间 10.19,10.20 节次 5-6.7-8.1-2.3-4 课程名称 无机化学 授课专业及层次 环境本,化工本/专,高分子本 授课内容 §7.1 氧化还原反应的基本概念 §7.2 电化学电池 §7.3 电极电势 学时数 2 教学目的 1.熟悉氧化还原反应的基本概念 2.熟悉原电池的构造,电动势与 G 关系 3 熟悉标准氢电极、甘汞电极及参比电极的概念。熟悉标准电极电势的概念。 4 掌握 Nernst 方程式的意义及其应用 重 点 原电池的构造,电动势与 G 关系, Nernst 方程式 难 点 可逆电池,电动势与 G 关系, Nernst 方程式 自学内容 使用教具 多媒体 相关学科知识 教 学 法 讲解 讲授内容纲要、要求及时间分配 §7.1 氧化还原反应的基本概念(简要讲) 7.1.1 氧化值〔氧化数〕: 1.化合价(原子价)与氧化值:化合价-原子成键数目; 氧化值- 形式电荷数 2 确定元素氧化值的规则:p.179 3 氧化值与化合价的区别: a.概念不同: b.数值不尽一致: 4 氧化还原反应: ①定义:元素的氧化值升、降(电子失、得) ②组成: 氧化反应,还原反应;半反应,电对 7.2.1 原电池的构造 1.原电池的概念: 将化学能转化成电能的装置。 2.构造原理:如 Daniell 电池 将氧化“半反应”和还原“半反应”在一定装置中“隔离”分开。 电极(半电池)反应 负极:Zn(s) = Zn2+(aq) + 2e 正极:Cu2+ +2e = Cu(s) 电池反应:Cu2+ + Zn(s) = Zn2+(aq) + Cu(s) 电池图示(电池符号): 例 7-3 p.186 10min 15min ( ) Zn(s) Zn (c ) Cu (c ) Cu(s) ( ) 2 2 1 2 − + + + ‖

讲授内容纲要、要求及时间分配(附页) 7.2.4原电池的最大功与Gibbs函数 10min 1.可逆电池的概念: (难点-化繁就简 (电极可逆 (2)电流无限小,电极反应接近平衡状态 2.可逆电池的最大电功:Wma=EM EMF-E,-E_ 3.电动势与热力学函数的关系: △rGm=-FEn△rGn8=-zFE 例7-4(1)p.189 §7.3电极电势 15min 7.3.1标准氢电极和甘汞电极一参比电极 1.标准氢电极(SHE) Pt(s)|H2(100 kPa)H(1 mol/L),H(mol/L)H(100 kPa)Pt(s) 电极反应:2H(1molL)+2e=H(100kPa) E(H/H)=0.00V 2.饱和甘汞电极(SCE) Hg()I(s)I CI(2.8mol/L) E(Hg:Cl:/Hg)=0.2415 V 7.3.2标准电极电势:E·=E,°-E_· 1.测定使待测半电池中各物种均处于标准态下,与SE组成原电池,以数字电压表测 定该电池的电动势并确定其正极和负极。 2.标准电极电势表:p.658附表6 7.3.3 Nernst方程式 20min l.Nernst方程式 (I),电动势的Nernst方程式 (T)=Ew (T)-R InJ (2)电极反应的Nernst方程式: 对电极反应M+2=Ms) RT /MD)-E'(M/MD- E298K)=E(298K)-0.0592r 2 例题7-5p.194
讲授内容纲要、要求及时间分配(附页) 7.2.4 原电池的最大功与 Gibbs 函数 ⒈可逆电池的概念: (难点-化繁就简) ⑴电极可逆 ⑵电流无限小,电极反应接近平衡状态 ⒉可逆电池的最大电功:Wmax = zFEMF EMF=E+-E- 3.电动势与热力学函数的关系: ΔrGm=-zFEMF ΔrGm =-zFEMF 例 7-4(1) p.189 §7.3 电极电势 7.3.1 标准氢电极和甘汞电极-参比电极 ⒈标准氢电极(SHE) Pt(s)│H2(100 kPa)│ H+ (1 mol/L) ,或 H+ (mol/L)│H2 (100 kPa)│Pt(s) 电极反应: 2 H+ (1mol/L)+2e-=H2(100kPa) E (H+/H2) = 0.00 V ⒉饱和甘汞电极(SCE) Hg(l) │Hg2Cl2(s)│Cl- (2.8mol/L) E(Hg2Cl2/Hg) = 0.2415 V 7.3.2 标准电极电势: EMF =E+ -E- 1.测定 使待测半电池中各物种均处于标准态下,与 SHE 组成原电池,以数字电压表测 定该电池的电动势并确定其正极和负极。 2.标准电极电势表:p.658 附表 6 7.3.3 Nernst 方程式 ⒈Nernst 方程式 ⑴.电动势的 Nernst 方程式 EMF(T)=EMF (T)- zF RT lnJ ⑵电极反应的 Nernst 方程式: 对电极反应 Mz++ze - = M(s) E(Mz+/M,T)=E (Mz+/M,T)- zF RT lnJ E(298K)=E (298K)- z 0.0592V 例题 7-5 p.194 10min 15min 20min

讲授内容纲要、要求及时间分配(附页) 2.难溶化合物、配合物的形成对电极电势的影响: ()生成难溶化合物对电极电势的影响 例题7-6p.194 结论:氧化型形成沉淀,E!还原型形成沉淀,E1。 (②)生成配合物对电极电势的影响 例题7-6p.195 结论:氧化型形成配合物,E!,还原型形成配合物,E1: 若二者都形成配合物,比较KP的相对大小。 KP(氧化型)>KP(还原型,则E!:反之,则E↑ *7.34E-pH图(简介) 1./E-pH图 2.O2/OHE-i图 小结和答疑 10min 练习:p.210思考题 p.212习题2,5,6
讲授内容纲要、要求及时间分配(附页) ⒉难溶化合物、配合物的形成对电极电势的影响: ⑴生成难溶化合物对电极电势的影响 例题 7-6 p.194 结论:氧化型形成沉淀 ,E↓;还原型形成沉淀 ,E↑。 ⑵生成配合物对电极电势的影响 例题 7-6 p.195 结论:氧化型形成配合物,E↓,还原型形成配合物,E↑; 若二者都形成配合物,比较 Kf 的相对大小。 Kf (氧化型) > Kf (还原型),则 E↓;反之,则 E↑ *7.34 E-pH 图 (简介) 1. H+/H2 E-pH 图 2. O2/OH- E-pH 图 小结和答疑: 练习:p.210 思考题 p.212 习题 2, 5,6 10min 10min 10min
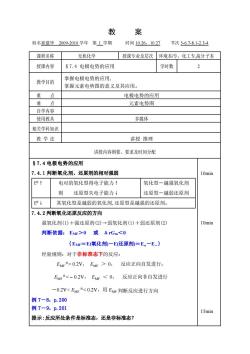
教 案 姓名崔建华20092010学年第1学期 时间10.26,1022 节次5-67-8.1-23-4 课程名称 无机化学 授课专业及层次环境本传,化工专,高分子本 授课内容 §7.4电极电势的应用 学时数 2 堂握由极由势的应用. 教学目的 掌握元素电势图的意义及其应用。 重点 电极电势的应用 难占 元素电势图 自学内容 使用教具 多媒体 相关学科知识 教学法 讲授推理 讲授内容纲要、要求及时间分配 §7.4电极电势的应用 7.4.1判断氧化剂、还原剂的相对强弱 10min E8 电对的氧化型得电子能力↑ 氧化型一越强氧化剂 则还原型失电子能力↓ 还原型一越弱还原剂 E9↓ 其氧化型是越弱的氧化剂,还原型是越强的还原剂。 7.4.2判断氧化还原反应的方向 强氧化剂(1)十强还原剂(②)→弱氧化剂(1)+弱还原剂(②) 10min 判断依据:Er>0或△rGm0.2V,EMe>0,反应正向自发进行: EMr<-0.2V,EMF<0,反应正向非自发进行 -0.2V<EM<0.2V,用EMF判断反应进行方向 例7-8,p.200 例7-9,p.201 15min 提示:反应所处条件是标准态,还是非标准态?
教 案 姓名崔建华 2009-2010 学年 第 1 学期 时间 10.26,10.27 节次 5-6.7-8.1-2.3-4 课程名称 无机化学 授课专业及层次 环境本/专,化工专,高分子本 授课内容 §7.4 电极电势的应用 学时数 2 教学目的 掌握电极电势的应用, 掌握元素电势图的意义及其应用。 重 点 电极电势的应用 难 点 元素电势图 自学内容 使用教具 多媒体 相关学科知识 教 学 法 讲授 推理 讲授内容纲要、要求及时间分配 §7.4 电极电势的应用 7.4.1 判断氧化剂、还原剂的相对强弱 E ↑ 电对的氧化型得电子能力↑ 则 还原型失电子能力↓ 氧化型-越强氧化剂 还原型-越弱还原剂 E ↓ 其氧化型是越弱的氧化剂,还原型是越强的还原剂。 7.4.2 判断氧化还原反应的方向 强氧化剂(1)+强还原剂(2)→弱氧化剂(1)+弱还原剂(2) 判断依据: EMF>0 或 ΔrGm<0 {EMF=E(氧化剂)-E(还原剂)=E+-E-} 经验规则:对于非标准态下的反应: EMF > 0.2V, EMF > 0, 反应正向自发进行; EMF < − 0.2V, EMF < 0, 反应正向非自发进行 -0.2V< EMF < 0.2V,用 EMF 判断反应进行方向 例 7-8,p.200 例 7-9,p.201 提示:反应所处条件是标准态,还是非标准态? 10min 10min 15min

讲投内容纲要、要求及时间分配(附页) 7.4.3确定氧化还原反应进行的限度一昶 15min InK0=zFEME@/RT 在298.15K下, nKe=zE9/0.0257V lgK0=zEr°0.0592V 例7-10p.202 例7-11p.202 20min 例7-12p.203 7.4.4元素电势图 20min 1.定义:氧化值从高到低排列 2.元素电势图的用途: (1)判断歧化反应 例7-13p.204 E9(右)>E9(左) B能发生歧化,B→A十C E9(右)<E9(左) B不能发生歧化,A十C一B (2).计算标准电极电势 A EB EC ED (z)() (z) Ex (Z) E9=(亿E+zE2+6E3/h 例7-14p.205 小结答疑: 10min 练习:p.212习题9(1,3,5,7),11,15,21
讲授内容纲要、要求及时间分配(附页) 7.4.3 确定氧化还原反应进行的限度-K lnK=zF EMF /RT 在 298.15K 下, lnK= z EMF /0.0257V lgK= zEMF /0.0592V 例 7-10 p.202 例 7-11 p.202 例 7-12 p.203 7.4.4 元素电势图 1. 定义:氧化值从高到低排列 2.元素电势图的用途: ⑴判断歧化反应 例 7-13 p.204 E (右)>E (左) B 能发生歧化, B→A+C E (右)<E (左) B 不能发生歧化,A+C→B ⑵.计算标准电极电势 A E 1 B E 2 C E 3 D (z1) (z2) (z3) Ex (Zx) Ex =(z1E1 +z2E2 +z3E3 )/zx 例 7-14 p.205 小结答疑: 练习:p.212 习题 9(1,3,5,7),11, 15, 21 15min 20min 20min 10min
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第四章 化学平衡、熵和Gibbs函数.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第八章 原子结构.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第五章 酸碱平衡.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)酸碱电离平衡.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)配位化合物.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)稀溶液依数性.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)氧化还原.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)固体结构.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)原子结构.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)化学平衡.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)化学反应速率.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)化学反应的方向和限度.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)分子结构.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)元素.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)临床药学教案.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)无机化学实验教案.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学大纲(负责人:陈红余).pdf
- 《分析化学》课程教学资源(讲义)分析化学总复习内容.doc
- 《分析化学》课程教学资源(讲义)卫生化学总复习内容.doc
- 山东第一医科大学(泰山医学院):《生物化学》课程教学资源(PPT课件)酶 Enzyme(二).ppt
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第九章 价层电子对互斥理论、分子轨道理论.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第六章 溶液.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第十一章 配位化合物.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第三章 化学反应速率的概念.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第二章 热化学.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)无机化学实验教案(主讲:孙红).doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)无机化学(中药学)教案讲义(共八章).doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)无机化学(制药工程)教案讲义.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)无机化学(药学)教案讲义.doc
- 《无机化学》课程PPT教学课件(讲稿)难溶电解质的沉淀溶解平衡.ppt
- 《无机化学》课程PPT教学课件(讲稿)难溶电解质的沉淀溶解平衡.ppt
- 《无机化学》课程PPT教学课件(讲稿)化学平衡.ppt
- 《无机化学》课程PPT教学课件(讲稿)化学反应的方向.ppt
- 《无机化学》课程PPT教学课件(讲稿)化学反应速率.ppt
- 《无机化学》课程PPT教学课件(讲稿)第九章 配位化合物.ppt
- 《无机化学》课程PPT教学课件(讲稿)第一章 溶液.ppt
- 《无机化学》课程PPT教学课件(讲稿)第七章 原子结构与元素周期律.ppt
- 《无机化学》课程PPT教学课件(讲稿)第十章 分子结构.ppt
- 《无机化学》课程PPT教学课件(讲稿)第八章 氧化还原反应.ppt
- 《无机化学》课程PPT教学课件(讲稿)难溶电解质的沉淀溶解平衡.ppt
