《无机化学》课程PPT教学课件(讲稿)第九章 配位化合物

第九章 配位化合物 配位化合物简称配合物,过去曾因它的组成比普通化合 物复杂而称为络合物。 §9.1 配位化合物的基本概念 什么是配位化合物 先请同学们看下列实验:
第九章 配位化合物 配位化合物简称配合物,过去曾因它的组成比普通化合 物复杂而称为络合物。 §9.1 配位化合物的基本概念 什么是配位化合物 先请同学们看下列实验:

第一节配位化合物的基本概念 一、配位化合物的定义 ·配合物是以具有接受电子 对的离子或原子(统称中 adding Anolnia 0 心原子)为中心,与一组 可以给出电子对的离子或 分子(统称配体),以一 定的空间排列方式在中心 原子周围所组成的质点 (NH3) plex (配离子或配分子)为特 征的化合物
第一节 配位化合物的基本概念 一、配位化合物的定义 • 配合物是以具有接受电子 对的离子或原子(统称中 心原子)为中心,与一组 可以给出电子对的离子或 分子(统称配体),以一 定的空间排列方式在中心 原子周围所组成的质点 (配离子或配分子)为特 征的化合物。 CuSO4 Solution adding NaOH Cu(OH)2 Precipitation adding ammonia [Cu(NH3 )4 ]SO4 Complex

逐滴加入6molL的氨水 继续滴加氨水 边加边搅拌 CuS0a溶液 天蓝色沉淀 深兰色溶液 滴加NaOH溶液 无Cu(oH)2沉淀说 明Cu2+存在 滴加少量BaC12溶液 有白色 深兰色溶液 的BaSO4沉淀 在上述深兰色溶液中加入适量的乙醇,有深兰色晶体析出。 经分折,深兰色晶体的组成是[Cu(NH3)4]SO4
在上述深兰色溶液中加入适量的乙醇,有深兰色晶体析出。 经分析,深兰色晶体的组成是[Cu(NH3)4 ]SO4

[Cu(NH3)4]SO4在水溶液中全部解离为[Cu(NH3)42+和SO2。 [Cu(NH3)4]2+是由1个Cu2+离子和4个NH3分子以配位键 形成的复杂离子。 我们把阳离子(或原子)与一定数目的阴离子或中性分 子以配位键形成的不易解离的复杂离子(或分子)称为配离 子(或配位分子)。 带正电荷的配离子称为配阳离子, 如:[Cu(NH3)4]2+、[Ag(NH3)2]+等;
[Cu(NH3)4 ]SO4在水溶液中全部解离为[Cu(NH3)4 ] 2+和SO4 2-。 [Cu(NH3)4 ] 2+是由1个Cu2+离子和4个NH3分子以配位键 形成的复杂离子。 我们把阳离子(或原子)与一定数目的阴离子或中性分 子以配位键 形成的不易解离的复杂离子(或分子)称为配离 子(或配位分子)。 带正电荷的配离子称为配阳离子, 如: [Cu(NH3)4 ] 2+ 、[Ag(NH3)2 ] +等;

带负电荷的配离子称为配明离子: 如:HgL4]P、Fe(NCS)4等。 Ni(CO)4]不带电荷,称为配位分子。 含有配离子的化合物和配位分子统称为配合物。 配合物可以是酸、碱、盐,也可以是电中性的配位分子。 如:H[Cu(CN)2]、[Cu(NH3)4](OH)2 [Cu(NH3)4]SO4、Ni(CO)4]都是配合物
如:[HgI4 ] 2-、[Fe(NCS)4 ] -等。 [Ni(CO)4 ]不带电荷,称为配位分子。 含有配离子的化合物和配位分子统称为配合物。 配合物可以是酸、碱、盐,也可以是电中性的配位分子。 带负电荷的配离子称为配阴离子; 如:H[Cu(CN)2 ]、[Cu(NH3)4 ](OH)2、 [Cu(NH3)4 ]SO4、[Ni(CO)4 ] 都是配合物
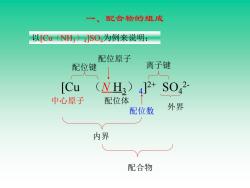
一、配合物的组成 以[Cu(NH)4SO4为例来说明: 配位原子 配位键 离子键 [Cu (NH)4SO2 中心原子 配位体 配位数 外界 内界 配合物
一、配合物的组成 [Cu (N H3)4 ] 2+ SO4 2- 中心原子 配位体 内界 配位原子 配位数 外界 配合物 配位键 离子键 以[Cu(NH3)4 ]SO4为例来说明:

(一)内界和外界 内界配离子是配合物的特征部分,由中心原子(或离子) 和配位体组成。通常把内界写在方括号内,与配离子带相反 电着的离子称为配合物的外界(outer sphere)。配离子与 外界离子所带电荷的总量相等,符号相反。 (二)中心原子 在配离子(或配位分子)中,接受孤电子对的阳离子 (或原子)统称为中,心原子(central atom)。 位于配离子的中心位置,是核心 NH)2+ 部分,通常是金属阳离子,或某些金 Cu 属原子以及高氧化态的非金属元素。 如:Ni(CO)4]及Fe(CO)]中的 NH, Ni原子及Fe原子和[Si证6]2-中的Si4+
(一)内界和外界 内界配离子是配合物的特征部分,由中心原子(或离子) 和配位体组成。通常把内界写在方括号内,与配离子带相反 电荷的离子称为配合物的外界(outer sphere)。配离子与 外界离子所带电荷的总量相等,符号相反。 (二)中心原子 在配离子(或配位分子)中,接受孤电子对 的阳离子 (或原子)统称为中心原子(central atom)。 位于配离子的中心位置,是核心 部分,通常是金属阳离子,或某些金 属原子以及高氧化态的非金属元素。 如:[Ni(CO)4 ]及[Fe(CO)3 ]中的 Ni原子及Fe原子和[SiF6 ] 2-中的Si4+

(三)配位体和配位原子 与中心原子以配位健结合的阴离子或中性分子称为配位体。 如:[Ag(NH3)2]、Ni(CO)4]和[SiF6J2-中的NH3 CO和F都是配位体。 配位体中直接向中心原子提供孤电子对形成配位键的 原子称为配位原子(ligating atom) 如:NH中的N、CO中的C、F中的F等。 配位原子的最外电子层上都有孤对电子,常见的是电负 性较大的非金属原子,如:N、O、C、S、F、CI、Br、I等。 单齿配体 配位体 多齿配体
(三)配位体和配位原子 与中心原子以配位键结合的阴离子或中性分子称为配位体。 如:NH3中的N、CO中的C、F -中的 F 等。 配位体中直接向中心原子提供孤电子对 形成配位键的 原子称为配位原子(ligating atom) 如:[Ag(NH3)2 ] + 、[Ni(CO)4 ]和[SiF6 ] 2-中的NH3、 CO和 F - 都是配位体。 配位原子的最外电子层上都有孤对电子,常见的是电负 性较大的非金属原子,如:N、O、C、S、F、Cl、Br、I等。 配位体 单齿配体 多齿配体
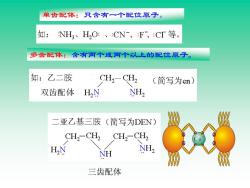
单齿配体:只含有一个配位原子。 如:NH、H,O:、:CN、:F、:CI等。 多齿配体:含有两个或两个以上的配位原子。 如:乙二胺 CH2-CH2 (简写为en) 双齿配体 H N NH2 二亚乙基三胺(简写为DEN) CH2-CH2 CH,-CH2 HN NH NH2 三齿配体
单齿配体:只含有一个配位原子。 多齿配体:含有两个或两个以上的配位原子。 三齿配体
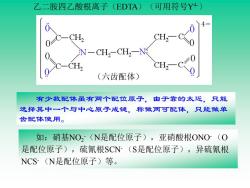
乙二胺四乙酸根离子(EDTA) (可用符号Y4) 0C CH2 ,-C0 C-CH2 (六齿配体) 有少数配体虽有两个配位原子,由于靠的太近,只能 选择其中一个与中心原子成键,称做两可配体,只能做单 齿配体使用。 如:硝基NO,(N是配位原子),亚硝酸根ONO(O 是配位原子),硫氰根$CN(S是配位原子),异硫氰根 NCS(N是配位原子)等
乙二胺四乙酸根离子(EDTA)(可用符号Y4-) 有少数配体虽有两个配位原子,由于靠的太近,只能 选择其中一个与中心原子成键,称做两可配体,只能做单 齿配体使用。 如:硝基NO2 -(N是配位原子),亚硝酸根ONO- (O 是配位原子),硫氰根SCN- (S是配位原子),异硫氰根 NCS- (N是配位原子)等
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《无机化学》课程PPT教学课件(讲稿)化学反应速率.ppt
- 《无机化学》课程PPT教学课件(讲稿)化学反应的方向.ppt
- 《无机化学》课程PPT教学课件(讲稿)化学平衡.ppt
- 《无机化学》课程PPT教学课件(讲稿)难溶电解质的沉淀溶解平衡.ppt
- 《无机化学》课程PPT教学课件(讲稿)难溶电解质的沉淀溶解平衡.ppt
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)无机化学(药学)教案讲义.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)无机化学(制药工程)教案讲义.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)无机化学(中药学)教案讲义(共八章).doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)无机化学实验教案(主讲:孙红).doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第二章 热化学.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第三章 化学反应速率的概念.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第十一章 配位化合物.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第六章 溶液.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第九章 价层电子对互斥理论、分子轨道理论.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第七章 氧化还原反应.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第四章 化学平衡、熵和Gibbs函数.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第八章 原子结构.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第五章 酸碱平衡.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)酸碱电离平衡.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)配位化合物.doc
- 《无机化学》课程PPT教学课件(讲稿)第一章 溶液.ppt
- 《无机化学》课程PPT教学课件(讲稿)第七章 原子结构与元素周期律.ppt
- 《无机化学》课程PPT教学课件(讲稿)第十章 分子结构.ppt
- 《无机化学》课程PPT教学课件(讲稿)第八章 氧化还原反应.ppt
- 《无机化学》课程PPT教学课件(讲稿)难溶电解质的沉淀溶解平衡.ppt
- 《无机化学》课程PPT教学课件(讲稿)第六章 酸碱平衡.ppt
- 《无机化学》课程PPT教学课件(讲稿)酸碱平衡复习.ppt
- 《无机化学》课程PPT教学课件(讲稿)第五章 酸碱平衡.ppt
- 《无机化学》课程PPT教学课件(讲稿)缓冲溶液及缓冲机制.ppt
- 《无机化学》课程PPT教学课件(讲稿)第十四章 过渡元素.ppt
- 《无机化学》课程PPT教学课件(讲稿)第十二章 非金属元素.ppt
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(实验指导)化学实验基本知识.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(实验指导)实验误差与数据处理.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(实验指导)某些试剂溶液的配制.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(实验指导)粗食盐的提纯与检验.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(实验指导)胃舒平药片中铝和镁的测定.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(实验指导)自来水中氯离子含量的测定.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(参考资料)习题.doc
- 《无机化学》课程教学资源(参考资料)原子量测定的历史回顾(一).doc
- 《无机化学》课程教学资源(参考资料)原子量测定的历史回顾(二).doc
