《无机化学》课程PPT教学课件(讲稿)化学反应速率

第三章化学反应速率 §3.1 化学反应速率和反应机理 §3.2 反应速率理论简介 §3.3影响反应速率的因素
第三章 化学反应速率 § 3.1 化学反应速率和反应机理 § 3.2 反应速率理论简介 § 3.3 影响反应速率的因素

§3.1化学反应速率和反应机理 一、化学反应速率的表示方法 化学反应速率一定条件下单位时间内某化学反应的反 应物转变为生成物的速率。 对于均匀体系的恒容反应,习惯用单位时间内反应物浓 度的减少或生成物浓度的增加来表示,而且习惯取正值。浓 度单位通常用moL,时间单位视反应快慢,可分别用秒 (s)、分(in)或小时(h)等表示。这样,化学反应速率的单位 可为moLl.sl、mol.L-1.min-l、molL-1.h-l
§3.1 化学反应速率和反应机理 一、化学反应速率的表示方法 化学反应速率 一定条件下单位时间内某化学反应的反 应物转变为生成物的速率。 对于均匀体系的恒容反应,习惯用单位时间内反应物浓 度的减少或生成物浓度的增加来表示,而且习惯取正值。浓 度单位通常用mol·L-1,时间单位视反应快慢,可分别用秒 (s)、分(min)或小时(h)等表示。这样,化学反应速率的单位 可为mol·L-1·s-1 、mol·L-1·min-1 、mol·L-1·h-1

二、化学反应的平均速率 室温时含有少量的情况下,过氧化氢水溶液的分解反 应为: H,0,(ag)IH0D+120,(g 由实验测定氧的量,便可计算出H,O,浓度的变化。若 有一份浓度为0.80ol/L的H,O,溶液,分解过程中的浓度 变化如表3-1 反应速率)=- c(HO2)2-c(H2O2)1_△c(H2O2) t2-ti △t
二、化学反应的平均速率 室温时含有少量I –的情况下,过氧化氢水溶液的分解反 应为: H2O2(aq)== H2O(l)+1/2O2(g) I - 由实验测定氧的量,便可计算出 H2O2 浓度的变化。若 有一份浓度为 0.80mol/L 的H2O2溶液,分解过程中的浓度 变化如表3-1 t c H O t t c H O c H O − − = − ( ) − ( ) ( ) 2 2 2 1 1 2 2 2 反应速率 2 2 =
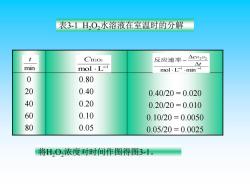
表3-1HO2水溶液在室温时的分解 t CH202 反应速率一 △CH202 mol.L-1 △t min mol.L min-1 0 0.80 20 0.40 0.40/20=0.020 40 0.20 0.20/20=0.010 60 0.10 0.10/20=0.0050 80 0.05 0.05/20=0.0025 将HO,浓度对时间作图得图3-1
表3-1 H2O2水溶液在室温时的分解 0 20 40 60 80 0.80 0.40 0.20 0.10 0.05 0.40/20 = 0.020 0.20/20 = 0.010 0.10/20 = 0.0050 0.05/20 = 0.0025 将H2O2浓度对时间作图得图3-1。 1 1 2 2 mol L min − − − t cH O 反应速率 1 H O mol L 2 2 − C min t

0.8 由图3-1可以 看出,在反应刚 0.6 开始时,第一个 20分钟内H202的 A 0.4 浓度降低较快, 以后逐渐减少, 0.2 B 因此表3-1中的 0仅表示某一个20 分钟间隔内的平均 20 40 60 80 速率(average rate) t/min △c(H2O2) 图3-1HO,分解反应的浓度-时间曲线图 △t
• • • C B A 0 20 40 60 80 0.2 0.4 0.6 0.8 t /min 图3-1 H2O2分解反应的浓度-时间曲线图 由图3-1可以 看出,在反应刚 开始时,第一个 20分钟内H2O2的 浓度降低较快, 以后逐渐减少, 因此表3-1 中的 υ 仅表示某一个20 分钟间隔内的平均 速率(average rate) t c H O = − ( ) 2 2

三、化学反应的瞬时速率 为了确切的表示反应的真实速率,通常用瞬时速率 (instantaneous rate =lim -△c(H,O2) dc(H,O,) △1->0 △t dt 反应的瞬时速率可通过作图法求得。 如要求在第20min时,H,O,分解的瞬时速度,可在图3-1 的曲线上找到对应于20min时的A点,求出曲线上A点切线 的斜率,即为第20min时的瞬时速率
三、化学反应的瞬时速率 为了确切的表示反应的真实速率,通常用瞬时速率 (instantaneous rate) dt dc H O t c H O t ( ) ( ) lim 2 2 2 2 0 = − − = → 反应的瞬时速率可通过作图法求得。 如要求在第20min时,H2O2分解的瞬时速度,可在图3-1 的曲线上找到对应于20min时的A点,求出曲线上A点切线 的斜率,即为第20min时的瞬时速率

即为第20min时的瞬时速率。(A点) (0.40-0.68)mo1L 020min =0.014mol.L.min-l 20min 求第40min时H,O,分解的瞬时速率,(B点) (0.20-0.50molL 040min =0.0075oL1.min-l 40min 求第60min时H2O2分解的瞬时速率,(C点) (0.10-0.33)mo1L U60min -=0.003&moL1.min1 60min
1 1 1 20min 0.014 min 2 0min 0.4 0 0.6 8 − − − = − = − mol L ( )mol L 求第40min时H2O2分解的瞬时速率,(B点) 1 1 1 40min 0.0075 min 4 0min 0.2 0 0.5 0 − − − = − = − mol L ( )mol L 求第60min时H2O2分解的瞬时速率,(C点) 1 1 1 60min 0.0038 min 6 0min 0.1 0 0.3 3 − − − = − = − mol L ( )mol L 即为第20min时的瞬时速率。(A点)

表3-2列出了HO,在不同浓度时分解的瞬时速率。 表3-2H,O,分解时的瞬时速率 C (H202)/(molL1) 0.40 0.20 0.10 0.050 )三 dc()mol.1.min).014 0.00750.0038 0.0019 dt 瞬时速率能确切表示化学反应在某一瞬间的真实速率。通常 所说的反应速率,一般指瞬时速率。对于反应A一B,其瞬 时速率可表示为: dCA 也可表 dCB V= 示为: V= dt dC表示在d瞬间内反应物或产物浓度的变量
表3-2 列出了H2O2在不同浓度时分解的瞬时速率。 表3-2 H2O2分解时的瞬时速率 c(H2O2)/(mol·L-1) 0.40 0.20 0.10 0.050 0.014 0.0075 0.0038 0.0019 2 2 1 1 / min ( ) − − = − mol L dt dc H O 瞬时速率能确切表示化学反应在某一瞬间的真实速率。通常 所说的反应速率,一般指瞬时速率。对于反应A B,其瞬 时速率可表示为: t C d d A = − t C d d B = 也可表 示为: dC表示在dt瞬间内反应物或产物浓度的变量

H202(aq)=H20(1)+1/202(g 反应的平均速率可用H,O,浓度的减少表示,也可用O,浓 度的增加来表示。如在第一个20min的平均速率是 0H,02= AC()0.40mol-L=.0x10mol.Lmin △t 20 min △C(O2)_0.20mol.L U02=+ =1.0×10-2mol.L.min- △t 20 min 显然,在这里用不同物质的浓度变化表示的速率之比是 2:1,它们之间的比值为反应方程式中相应物质分子式 前的系数比。 对于一般反应: aA+bB=gG+hH 1 dCA 1 dCB 1 dCG 1 dCH a dt b dt g dt h dt
H2O2(aq)== H2O(l)+1/2O2(g) 反应的平均速率可用H2O2浓度的减少表示,也可用O2浓 度的增加来表示。如在第一个20min的平均速率是 2 1 1 1 2 2 H O 2.0 10 mol L min 20min ( ) 0.40mol L 2 2 − − − − = = = − t C H O 2 1 1 1 2 O 1.0 10 mol L min 20min ( ) 0.20mol L 2 − − − − = = = + t C O 显然,在这里用不同物质的浓度变化表示的速率之比是 2:1,它们之间的比值为反应方程式中相应物质分子式 前的系数比。 对于一般反应: aA + bB = gG + hH t C t h C t g C t b C a d 1 d d 1 d d 1 d d 1 d A B G H − = − = =

二、 反应机理慨念 反应机理(reaction mechanism)就是化学反应经历的 途径或具体步骤,也称为反应历程。 由反应物一步就直接转变为生成物的反应称为基元反应, 又称元反应。如 CO (g)+H2O(g)=CO2 (g)+H2 (g) 由两个或两个以上的基元反应组成的化学反应称为非 基元反应,也叫总反应。如: H2(g)+I2(g)=2HⅡ(g) 它是由两步组成的: 1)I2(g)=2I(g) 快反应 、2)H2(g)+2I(g)=2HⅡ(g)慢反应(速率控制步骤
二、反应机理概念 反应机理(reaction mechanism)就是化学反应经历的 途径或具体步骤,也称为反应历程。 由反应物一步就直接转变为生成物的反应称为基元反应, 又称元反应。如: CO(g)+ H2O(g)= CO2(g)+ H2(g) 由两个或两个以上的基元反应组成的化学反应称为非 基元反应,也叫总反应。如: H2(g)+ I2(g)= 2HI(g) 它是由两步组成的: (1) I2(g)= 2I(g) 快反应 (2) H2(g)+ 2I(g)= 2HI(g)慢反应(速率控制步骤)
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《无机化学》课程PPT教学课件(讲稿)化学反应的方向.ppt
- 《无机化学》课程PPT教学课件(讲稿)化学平衡.ppt
- 《无机化学》课程PPT教学课件(讲稿)难溶电解质的沉淀溶解平衡.ppt
- 《无机化学》课程PPT教学课件(讲稿)难溶电解质的沉淀溶解平衡.ppt
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)无机化学(药学)教案讲义.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)无机化学(制药工程)教案讲义.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)无机化学(中药学)教案讲义(共八章).doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)无机化学实验教案(主讲:孙红).doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第二章 热化学.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第三章 化学反应速率的概念.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第十一章 配位化合物.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第六章 溶液.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第九章 价层电子对互斥理论、分子轨道理论.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第七章 氧化还原反应.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第四章 化学平衡、熵和Gibbs函数.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第八章 原子结构.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)第五章 酸碱平衡.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)酸碱电离平衡.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)配位化合物.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(授课教案)稀溶液依数性.doc
- 《无机化学》课程PPT教学课件(讲稿)第九章 配位化合物.ppt
- 《无机化学》课程PPT教学课件(讲稿)第一章 溶液.ppt
- 《无机化学》课程PPT教学课件(讲稿)第七章 原子结构与元素周期律.ppt
- 《无机化学》课程PPT教学课件(讲稿)第十章 分子结构.ppt
- 《无机化学》课程PPT教学课件(讲稿)第八章 氧化还原反应.ppt
- 《无机化学》课程PPT教学课件(讲稿)难溶电解质的沉淀溶解平衡.ppt
- 《无机化学》课程PPT教学课件(讲稿)第六章 酸碱平衡.ppt
- 《无机化学》课程PPT教学课件(讲稿)酸碱平衡复习.ppt
- 《无机化学》课程PPT教学课件(讲稿)第五章 酸碱平衡.ppt
- 《无机化学》课程PPT教学课件(讲稿)缓冲溶液及缓冲机制.ppt
- 《无机化学》课程PPT教学课件(讲稿)第十四章 过渡元素.ppt
- 《无机化学》课程PPT教学课件(讲稿)第十二章 非金属元素.ppt
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(实验指导)化学实验基本知识.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(实验指导)实验误差与数据处理.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(实验指导)某些试剂溶液的配制.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(实验指导)粗食盐的提纯与检验.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(实验指导)胃舒平药片中铝和镁的测定.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(实验指导)自来水中氯离子含量的测定.doc
- 山东第一医科大学(泰山医学院):《无机化学》课程教学资源(参考资料)习题.doc
- 《无机化学》课程教学资源(参考资料)原子量测定的历史回顾(一).doc
