中国科学技术大学:《化学原理》课程教学资源(讲义)Chapter 08 化学键和分子、晶体结构 Chemical Bonds and Structures of Molecules & Crystals

简中国绅草术大空 University of Science and Technology of China 第八章化学键和分子、晶体结构 Chapter 8 Chemical Bonds and Structures of Molecules Crystals
第八章 化学键和分子、晶体结构 Chapter 8 Chemical Bonds and Structures of Molecules & Crystals

本章重点 >化学键:分子内部原子之间的强相互作用力 ·共价键,离子键,金属键 Lewis:结构,VB理论、杂化理论、价层电子对互斥理论 MO理论、晶格能计算,离子极化、能带论 >化学键与分子结构性质 ·键长、键角、键极、键能 >弱相互作用: ·分子间作用力,氢键 >物质结构决定性质:化学的核心 ·晶体结构:密堆积、晶系性质、常见晶体结构
本章重点 化学键:分子内部原子之间的强相互作用力 • 共价键,离子键,金属键 Lewis结构,VB理论、杂化理论、价层电子对互斥理论 MO理论、晶格能计算,离子极化、能带论 化学键与分子结构/性质 • 键长、键角、键极、键能 弱相互作用: • 分子间作用力,氢键 物质结构决定性质:化学的核心 • 晶体结构:密堆积、晶系性质、常见晶体结构 2

§8.1共价键与分子几何构型 一、经典共价键理论:Lewis结构 1.基本思想: >分子形成:原子间共用电子对形成化学键一共价键 >成键规则:每个原子成八电子构型(s2p,除1s2外) >表示方法:Lewis结构式 ①)点式:全部用小黑点表示价电子,共享电子对~孤电子对 山点线式:短线表示共享电子对:小黑点表示孤电子对 山)线式:只讨论共价分子成键情况,而不考虑孤电子对 H:N:H H-N-H H-N-H H H H ①点式 )点线式(最常见) (四)线式(更简洁)
一、经典共价键理论:Lewis结构 1.基本思想: 分子形成:原子间共用电子对形成化学键 — 共价键 成键规则:每个原子成八电子构型 ( n s 2 n p 6,除1s 2 外 ) 表示方法:Lewis结构式 (I) 点式:全部用小黑点表示价电子 ,共享电子对~孤电子对 (II) 点线式:短线表示共享电子对;小黑点表示孤电子对 (III) 线式:只讨论共价分子成键情况,而不考虑孤电子对 §8.1 共价键与分子几何构型 : N : : : H H H (I) 点式 : N H H H (II) 点线式 (最常见 ) N H H H (III) 线式 (更简洁 )

2.共价分子中成键数和孤电子对数的计算 >对每一个原子:成键数×2+孤电子数=8 ·n。:所有原子为8电子构型(H为2)所需的电子总数 ·nv:所有原子的价电子数总和 ·n。:所有原子之间共享电子总数 >显然n、=n。-n,成键数=n/2=(n。-nv)/2 孤电子数n=n,-n。,孤电子对数=n/2=(n,-n)/2 P4S3 HNg N H2CN2 NO3 no 7×8=56 2+3×8=26 5×8=40 2×2+8×3=28 4×8=32 4×5+3×6= 1+3×5=165×5-1=24 1×2+4+5×2= nv 5+6×3+1=24 38 16 n、/2 (40-24)/2= (56-38)/2=9 (26-16/2=5 8 (28-16)/2=6 (32-24)/2=4 n1/2(38-18)/2=10(16-10/2=-3(24-16/2=4 (16-12)/2=2 (24-8)/2=8
2.共价分子中成键数和孤电子对数的计算 对每一个原子:成键数 2 + 孤电子数 = 8 • no :所有原子为8 电子构型(H为2)所需的电子总数 • n v :所有原子的价电子数总和 • ns :所有原子之间共享电子总数 显然 ns = no nv , • 孤电子数 nl = nv ns , 成键数 = ns / 2 = (no nv)/2 孤电子对数 = nl / 2 = (nv ns)/2 P4S3 HN3 N H2CN2 NO no 7×8 = 56 2 + 3×8 = 26 5×8 = 40 2×2 + 8×3 = 28 4×8 = 32 nv 4×5 + 3×6 = 38 1 + 3×5 = 16 5×5 1 = 24 1×2 + 4 + 5×2 = 16 5 + 6×3 + 1 = 24 ns / 2 (56 38)/2 = 9 (26 16)/2 = 5 (40 24) / 2 = 8 (28 16)/2 = 6 (32 24)/2 = 4 nl / 2 (38 18)/2 =10 (16 10)/2 = 3 (24 16)/2 = 4 (16 12)/2 = 2 (24 8)/2 = 8 5 3

3.Lewis结构式的书写 >如何找出正确的原子链接方式? 。 物质名称和元素化学基本知识N? HN-N-N √例如:HN3叠氮酸 HN-N=N: 。 等电子体:重原子一般构型相同 ● 中心原子和端点原子的确定: N=N一: √电负性较小的原子常处于分子中 √电负性较大的原子一般排列在分子的终端 >书写步骤: P4S3 ·确定骨架,放置单键 :S S: ·双键,三键 ·加孤对电子 P 5
3.Lewis 结构式的书写 H H H 如何找出正确的原子链接方式? • 物质名称和元素化学基本知识 例如:HN3 叠氮酸 • 等电子体:重原子一般构型相同 • 中心原子和端点原子的确定: 电负性较小的原子常处于分子中 电负性较大的原子一般排列在分子的终端 书写步骤: • 确定骨架,放置单键 • 双键,三键 • 加孤对电子 5

4.Lewis结构式稳定性的判据:形式电荷Q (1)Q定义: >若共用电子平均分配给成键原子,原子所带的电荷数 ·例如:N与CO,成键数3,孤电子对数2,N的Q为0 e √氧原子的Q为+1 c.o √碳原子的Q为-1 ·是共价键形成的平等与否的标志,与原子实际吸引电 子能力(即元素电负性)无关 >多种Lewis结构式,Qr稳定性判据: ·Q应尽可能小 ·两相邻原子之间的Q尽可能避免同号 ·若Q与元素电负性一致,则该结构更稳定 6
4.Lewis 结构式稳定性的判据:形式电荷QF (1) QF定义: 若共用电子平均分配给成键原子,原子所带的电荷数 • 例如:N2与CO,成键数3,孤电子对数2,N的QF为0 • 是共价键形成的平等与否的标志,与原子实际吸引电 子能力 (即元素电负性) 无关 多种Lewis结构式,QF稳定性判据: • QF应尽可能小 • 两相邻原子之间的QF尽可能避免同号 • 若QF与元素电负性一致,则该结构更稳定 氧原子的QF为+1 碳原子的QF为1 6
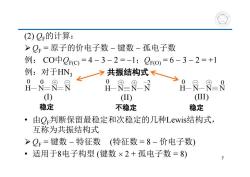
(2)Q的计算: >Q=原子的价电子数-键数-孤电子数 例:C0中00=4-3-2=-1;Qo,=6-3-2=+1 例:对于HN? 了共振结构式、 HN-8 :周=8 RR8 0 (①) (I) (I1) 稳定 不稳定 稳定 ·由Q判断保留最稳定和次稳定的几种Lewis结构式, 互称为共振结构式 >Q=键数-特征数(特征数=8-价电子数) ·适用于8电子构型(键数×2+孤电子数=8) 7
(2) QF的计算: QF = 原子的价电子数 键数 孤电子数 例: CO中QF(C) = 4 3 2 = 1;QF(O) = 6 3 2 = +1 例:对于HN3 • 由QF判断保留最稳定和次稳定的几种Lewis结构式, 互称为共振结构式 QF = 键数 特征数 (特征数 = 8 价电子数) • 适用于8电子构型 (键数 2 + 孤电子数 = 8) 稳定 不稳定 稳定 共振结构式 7

·例:O,的Lewis共振结构 .⊕ · 或 ·例:CHN2(重氮甲烷)H 8月 ⊕ N=N: H H ⊙⊕ ⊕⊕⊙ 。例:N ⊕ N-N-N-N-N :N=N-】 8 ④ ⊕ ⊕ N-N-N-N-N: :N=N-i -8周 >中性分子的Q的代数和=0 >共价离子团的Q的代数和=离子电荷数 8
• 例:O3的Lewis共振结构 • 例:CH2N2 (重氮甲烷) • 例: 中性分子的QF的代数和 = 0 共价离子团的QF的代数和 = 离子电荷数 , H C H N N H C H N N N5 2 8

5.Lewis结构式的应用 (1)判断结构的稳定性 >多原子共价分子离子团:原子间多种排列方式 >例如: ·C02:OC0还是C00? ·NO:NNO还是NON? cyanate ion OCN-比fulminate ion CNO-稳定? (2)计算共价分子/离子团中原子之间的键级 >键级:键合两原子形成化学键的重数,键相对强度 ·例如: CH共振结构式为一〔 其C一C键级=(1+2)/2=3/2 9
5.Lewis 结构式的应用 (1) 判断结构的稳定性 多原子共价分子/离子团:原子间多种排列方式 例如: • CO2 :OCO 还是 COO? • N2O :NNO 还是 NON? • cyanate ion OCN-比 fulminate ion CNO-稳定? (2) 计算共价分子/离子团中原子之间的键级 键级:键合两原子形成化学键的重数,键相对强度 • 例如: C6H6 共振结构式为 其C-C键级 = (1 +2) / 2 = 3/2 9
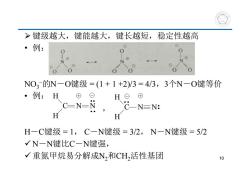
>键级越大, 键能越大,键长越短,稳定性越高 ·例: NO3的N一O键级=(1+1+2)/3=4/3,3个N一O键等价 ·例:H ⊕ HO⊕ C-N-N CNEN: H H H一C键级=1,C一N键级=3/2,N一N键级=5/2 √N一N键比C一N键强, √重氮甲烷易分解成N,和CH,活性基团 10
键级越大,键能越大,键长越短,稳定性越高 • 例: NO3的N-O键级 = (1 + 1 +2)/3 = 4/3,3个N-O键等价 • 例: H-C键级 = 1, C-N键级 = 3/2, N-N键级 = 5/2 N-N键比C-N键强, 重氮甲烷易分解成N2和CH2活性基团 , H C H N N H C H N N 10
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 中国科学技术大学:《化学原理》课程教学资源(讲义)Chapter 07 原子结构和元素周期律 The Atomic Structure and Periodic System of Elements.pdf
- 中国科学技术大学:《化学原理》课程教学资源(讲义)Chapter 06 化学动力学基础 The Basis of Chemical Dynamics.pdf
- 中国科学技术大学:《化学原理》课程教学资源(讲义)Chapter 05 氧化-还原反应和电化学 Oxidation-Reduction Reactions & Electrochemistry.pdf
- 中国科学技术大学:《化学原理》课程教学资源(讲义)Chapter 04 沉淀反应 The Precipitation Reactions.pdf
- 中国科学技术大学:《化学原理》课程教学资源(讲义)Chapter 03 酸碱理论与电离平衡 The Theories of Acids & Bases and Ionization Equilibrium.pdf
- 中国科学技术大学:《化学原理》课程教学资源(讲义)Chapter 02 化学热力学基础与化学平衡 The Basis of Chemical Thermodynamics & Chemical Equilibrium.pdf
- 中国科学技术大学:《化学原理》课程教学资源(讲义)Chapter 01 气体、液体和溶液的性质 The behaviors of Gas, Liquid & Solution.pdf
- 中国科学技术大学:《化学原理》课程教学资源(讲义)Chapter 00 绪论 The Principles of Chemistry(授课教师:汪文栋).pdf
- 南京大学:《现代有机合成》课程教学资源(课件讲义)08 Strychine.pdf
- 南京大学:《现代有机合成》课程教学资源(课件讲义)07 Tamiflu.pdf
- 南京大学:《现代有机合成》课程教学资源(课件讲义)06 Evaluation.pdf
- 南京大学:《现代有机合成》课程教学资源(课件讲义)05 Starting Materials.pdf
- 南京大学:《现代有机合成》课程教学资源(课件讲义)04 Retrosynthesis Part B.pdf
- 南京大学:《现代有机合成》课程教学资源(课件讲义)03 Retrosynthesis Part A.pdf
- 南京大学:《现代有机合成》课程教学资源(课件讲义)02 Pretreatment and Target Analysis.pdf
- 南京大学:《现代有机合成》课程教学资源(课件讲义)01 General(主讲:姚祝军).pdf
- 《基础化学》课程教学资源(PPT课件)第5章 氧化还原和电化学.ppt
- 《基础化学》课程教学资源(PPT课件)第4章 滴定分析法和酸碱滴定.pptx
- 《基础化学》课程教学资源(PPT课件)第3章 电解质溶液和离解平衡.pptx
- 《基础化学》课程教学资源(PPT课件)第2章 化学反应速度与化学平衡.pptx
- 中国科学技术大学:《化学原理》课程教学资源(试卷习题)化学原理各章习题(答案,共二十章).pdf
- 中国科学技术大学:《化学原理》课程教学资源(试卷习题)化学原理各章习题(试题,共二十章).pdf
- 中国科学技术大学:《化学原理》课程教学资源(无机化学)Chapter 09 配位化合物 The coordination compounds.pdf
- 中国科学技术大学:《化学原理》课程教学资源(无机化学)Chapter 10 稀有气体 Chapter 10 The Rare Gases.pdf
- 中国科学技术大学:《化学原理》课程教学资源(无机化学)Chapter 11 氢、碱金属和碱土金属 Hydrogen, Alkali and Alkali-earth metals.pdf
- 中国科学技术大学:《化学原理》课程教学资源(无机化学)Chapter 12 卤素 The Halogens.pdf
- 中国科学技术大学:《化学原理》课程教学资源(无机化学)Chapter 13 氧族元素 Oxygen Family Elements.pdf
- 中国科学技术大学:《化学原理》课程教学资源(无机化学)Chapter 14 氮族元素 Nitrogen Family Elements.pdf
- 中国科学技术大学:《化学原理》课程教学资源(无机化学)Chapter 15 碳族元素 The Carbon Family Elements.pdf
- 中国科学技术大学:《化学原理》课程教学资源(无机化学)Chapter 16 硼族元素 The Boron Family Elements.pdf
- 中国科学技术大学:《化学原理》课程教学资源(无机化学)Chapter 17 铜锌分族 The Copper Subgroup and Zinc Subgroup.pdf
- 中国科学技术大学:《化学原理》课程教学资源(无机化学)Chapter 18 过渡元素 The Transition Elements(1/2).pdf
- 中国科学技术大学:《化学原理》课程教学资源(无机化学)Chapter 19 过渡元素 The Transition Elements(2/2).pdf
- 中国科学技术大学:《化学原理》课程教学资源(无机化学)Chapter 20 镧系元素和锕系元素 The Lanthanides and the Actinides.pdf
- 中国科学技术大学:《有机化学 Organic Chemistry》课程教学资源(课件讲义)10 醇酚醚.pdf
- 中国科学技术大学:《有机化学 Organic Chemistry》课程教学资源(课件讲义)11 醛酮醌.pdf
- 中国科学技术大学:《有机化学 Organic Chemistry》课程教学资源(课件讲义)01 绪论 Organic Chemistry(主讲教师:谷永红).pdf
- 中国科学技术大学:《有机化学 Organic Chemistry》课程教学资源(课件讲义)02 烷烃 Alkane.pdf
- 中国科学技术大学:《有机化学 Organic Chemistry》课程教学资源(课件讲义)03 烯烃 Alkene.pdf
- 中国科学技术大学:《有机化学 Organic Chemistry》课程教学资源(课件讲义)04 二烯烃和炔烃 Diene and Alkyne.pdf
