《生物化学》课程教学资源(文献资料)实验教程

、生化实验基本技术(一)光谱光度分析技术利用各种化学物质一一包括原子、基团、分子及高分化合物,所具有的发射、吸收或散射光谱谱系(带、线)的特征来确定其性质、结构及含量的技术,称为光谱光度分析技术(spectrmspectrophotometryanalysistechnology)。光属于电磁波,由连续的、波长渐变的谱线组成。肉眼可见的部分称为可见光,分光后,具有红、橙、黄、绿、兰及紫色彩。红光波长较长、紫光波长较短。红外光及紫外光均为肉眼不可见。如表1所示,如果两种光按一定比例混合后,可以得到白光,这两种光称为互补色光。表1波长与色泽及其互补色泽的关系色泽近似波长范围(nm)互补色泽10~200远紫外(不可见)200~400近紫外(不可见)绿紫400~430蓝黄430~460青橙红460~490490~570绿紫红黄蓝570~600橙青600~630红蓝绿630~780(2.5~50)X103红外(不可见)(50~300)×103远红外(不可见)物质分子内部具有(1)电子运动能量(2)分子振动能量及(3)分子转动能量三种能级。这些能级的跃迁可决定物质对光谱的吸收波长。而影响能级跃迁,主要决定于分子内部的双键数目、未共享电子对的共轭状态和几何排列以及饱和基对它们围绕状态。主要的基团及特有的吸收峰如表2.表2主要发色基团的吸收峰基因吸收波长nm基因吸收波长nm乙烯基175亚硝酸基230乙炔基基210160羧基330180~320硫铜基硝酸基270亚硝基300光谱是复合光经色散后的单色光按一定顺序排成一幅光的色谱。光谱光度分析技术,即是在物质分子结构与光谱特征密切相关的基础上建立起来的。按原理,又可分为:(1)吸收光谱分析;(2)发射光谱分析;(3)散射光谱分析三大类,简述于后。1.吸收光谱分析(1)透光度与吸光度1
1 一、生化实验基本技术 (一)光谱光度分析技术 利用各种化学物质-包括原子、基团、分子及高分化合物,所具有的发射、吸收或散射 光谱谱系(带、线)的特征来确定其性质、结构及含量的技术,称为光谱光度分析技术(spectrm spectrophotometry analysis technology)。 光属于电磁波,由连续的、波长渐变的谱线组成。肉眼可见的部分称为可见光,分光后, 具有红、橙、黄、绿、兰及紫色彩。红光波长较长、紫光波长较短。红外光及紫外光均为肉 眼不可见。 如表 1 所示,如果两种光按一定比例混合后,可以得到白光,这两种光称为互补 色光。 表 1 波长与色泽及其互补色泽的关系 ───────────────────────────── 近似波长范围(nm) 色 泽 互补色泽 ───────────────────────────── 10~200 远紫外(不可见) 一 200~400 近紫外(不可见) 一 400~430 紫 绿 430~460 蓝 黄 460~490 青 橙红 490~570 绿 紫红 570~600 黄 蓝 600~630 橙 青 630~780 红 蓝绿 (2.5~50)×103 红外(不可见) 一 (50~300)×103 远红外(不可见) 一 ───────────────────────────── 物质分子内部具有⑴电子运动能量⑵分子振动能量及⑶分子转动能量三种能级。这些能 级的跃迁可决定物质对光谱的吸收波长。而影响能级跃迁,主要决定于分子内部的双键数目、 未共享电子对的共轭状态和几何排列以及饱和基对它们围绕状态。主要的基团及特有的吸收 峰如表 2. 表 2 主要发色基团的吸收峰 ───────────────────────── 基因 吸收波长 nm 基因 吸收波长 nm ───────────────────────── 乙烯基 175 亚硝酸基 230 乙炔基 160 腈 基 210 羧 基 180~320 硫铜基 330 硝酸基 270 亚硝基 300 ───────────────────────── 光谱是复合光经色散后的单色光按一定顺序排成一幅光的色谱。光谱光度分析技术,即 是在物质分子结构与光谱特征密切相关的基础上建立起来的。按原理,又可分为:⑴吸收光 谱分析;⑵发射光谱分析;⑶散射光谱分析三大类,简述于后。 1.吸收光谱分析 ⑴透光度与吸光度
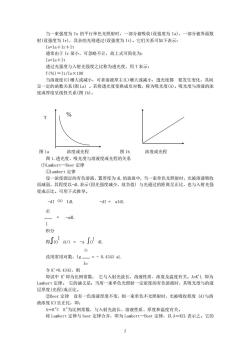
当一束强度为Io的平行单色光照射时,一部分被吸收(设强度为Ia),一部分被界面散射(设强度为Ir),其余的光则透过(设强度为It)。它们关系可如下表示:Io=Ia+Ir+It通常由于Ir很小,可忽略不计,故上式可简化为:Io=Ia+It透过光强度与入射光强度之比称为透光度,用T表示:T(%)=It/10X100当溶液度(C)增大或减小,可者溶液厚主(L)增大或减小,透光度都要发生变化,其间呈一定的函数关系(图La)。若将透光度变换成负对数,称为吸光度(A)。吸光度与溶液的浓度或厚度呈线性关系(图1b)。%T图1b图1a浓度或光程浓度或光程图1.透光度、吸光度与溶液度或光程的关系(2)Lambert--Beer定律①Lambert定律设一浓度固定的有色溶液,置厚度为L的玻皿中,当一束单色光照射时,光被溶液吸收而减弱,其程度以-dL表示(因光强度减少,故负值)与光通过的距离呈正比,也与入射光强度成正比。可用下式推导。-dI IdL-dI = aldLdI-adL-I积分得Jio dl/I =- -a Jol aIt改用常用对数,1g=-0.4343aL1o令K'=0.4343,则即试中K即为比例常数,它与入射光波长,溶液性质、浓度及温度有关。A=KL即为Lambert定律。它的涵义是:当用一束单色光照射一定浓度的有色溶液时,其吸光度与的液层厚度(光程)成正比。②Beer定律设有一色溶液厚度不变,则一束单色不光照射时,光被吸收程度(A)与溶液浓度(C)呈正比,即:A=K"CK”为比例常数,与入射光波长、溶液性质、厚度和温度有关。将Lambert定律与beer定律合并,即为Lambert--Beet定律,以A=KCL表示之。它的2
2 当一束强度为 Io 的平行单色光照射时,一部分被吸收(设强度为 Ia),一部分被界面散 射(设强度为 Ir),其余的光则透过(设强度为 It)。它们关系可如下表示: Io=Ia+Ir+It 通常由于 Ir 很小,可忽略不计,故上式可简化为: Io=Ia+It 透过光强度与入射光强度之比称为透光度,用 T 表示: T(%)=It/Io×100 当溶液度(C)增大或减小,可者溶液厚主(L)增大或减小,透光度都 要发生变化,其间 呈一定的函数关系(图 La)•。若将透光度变换成负对数,称为吸光度(A)。吸光度与溶液的浓 度或厚度呈线性关系(图 1b)。 图 1a 浓度或光程 图 1b 浓度或光程 图 1.透光度、吸光度与溶液度或光程的关系 ⑵Lambert-Beer 定律 ①Lambert 定律 设一浓度固定的有色溶液,置厚度为 dL 的玻皿中,当一束单色光照射时,光被溶液吸收 而减弱,其程度以-dL 表示(因光强度减少,故负值)•与光通过的距离呈正比,也与入射光强 度成正比。可用下式推导。 -dI ∞ IdL -dI = aIdL dI = -adL I 积分 得∫IO I dI/I = -a ∫O I dL It 改用常用对数,lg = - 0.4343 aL Io 令 K'=0.4343,则 即试中 K'即为比例常数, 它与入射光波长,溶液性质、浓度及温度有关。A=K'L 即为 Lambert 定律。 它的涵义是:当用一束单色光照射一定浓度的有色溶液时,其吸光度与的液 层厚度(光程)成正比。 ②Beer 定律 设有一色溶液厚度不变,则一束单色不光照射时,光被吸收程度•(A)与溶 液浓度(C)呈正比,即: A=K"C K"为比例常数,与入射光波长、溶液性质、厚度和温度有关。 将 Lambert 定律与 beer 定律合并,即为 Lambert-Beet 定律,以 A=KCL 表示之。它的 T %

涵义是:当一束单色光照射有色溶液时,其吸光度与溶液的浓度和厚度的乘积成正比。值得注意的是:溶液的厚度和浓度须在一定范围内,Lambert--Beer定律方才成立。当溶液的厚度固定为1cm时,对于某有色溶液在特定波长时的K值即为消光系数。(3)仪器简介常用吸收光谱仪器的工作原理可由图2示意尺1125346说明:1.光源2.透镜3.狭缝4.色散器5.比色血6.光电管及倍增管7.检流汁图2吸收光谱仪工作原理示图各类型仪器主要有:①光电比色计:如581型、GBS型等。是用滤色片滤去不需要的光谱而获得近似单色光(谱带较宽),如红光、绿光和蓝光。以光电池接受透过光。②可见光分光光度计,以卤钨灯为光源,具有色散系统(棱镜分光),以光电管接收透过光并经放大后再输入检流计。以721型最为普及。(3)紫外分光光度计:以氛灯作为光源,如核酸分析仪。必须使用石英比色皿。紫外与可见光两种光学系统组合在一起。如751、753、79、80型等。以光栅分光、数字显字吸光度(A)、透光度(T)并可转换成浓度(C)。有的还可附设打印系统。③半自动、全自动生化分析仪:从进样检测到发报告以及清洗均为微机控制程序。③原子吸收分光光度计:在燃气或高温条件下,样品原子化。其吸收特定波长的谱线后,原子跃迁到激发态。(激发态原子返迁回基态时,又放出电磁波。)吸收光量的多少与原子化的程度或样品的浓度有关。原子吸收分光光度计较普通分光光度计灵敏,主要用于检测微量元素。2.发射光谱分析主要有火焰激发光谱分析和荧光光谱分析。(1)火焰激发光谱分析原理:火焰使雾化样本产生原子化,外层电子跃迁到较高能级。此为激发态原子,极不稳定,返迁回基态后,发射出特定的谱线,其强弱与样本中该元素的浓度相关。火焰光度法主要用于人体常量元素,如K、Na、Ca的检测。仪器:火焰光度计(2)荧光不度分析法原理:荧光物质在紫光到紫外光谱激发下发出波长较长的谱线(多为红色)发生荧光其强弱与样本中荧光物质的浓度成正比。仪器:荧光光度计、荧光分光光度计。最近国外研制出时间分辨免疫荧光光度技术和相应的设备,把荧光检测技术推上一新的高度。(3)化学发光法采用化学发光仪检测化学反应中发出的光信号。3.散射、透射光谱分析原理:光线通过悬浊的介质溶液时,同时会发生反射、散射及透射现象,散射光强度与溶液中混悬颗粒的量成正比,测量散射光强度用以分析样本中的待测成分,称散射光谱分析。使用仪器为浊度计。如激光浊度计。3
3 涵义是:当一束单色光照射有色溶液时,其吸光度与溶液的浓度和厚度的乘积成正比。 值得注意的是:溶液的厚度和浓度须在一定范围内,Lambert-Beer 定律方才成立。 当溶液的厚度固定为 1cm 时,对于某有色溶液在特定波长时的 K 值即为消光系数。 ⑶仪器简介 常用吸收光谱仪器的工作原理可由图 2 示意 1 2 3 4 5 6 7 说明:1.光源 2.透镜 3.狭缝 4.色散器 5.比色皿 6.光电管及倍增管 7.检流汁 图 2 吸收光谱仪工作原理示图 各类型仪器主要有: ①光电比色计:如 581 型、GBS 型等。是用滤色片滤去不需要的光谱而获得近似单色光(谱 带较宽),如红光、绿光和蓝光。以光电池接受透过光。 ②可见光分光光度计,以卤钨灯为光源,具有色散系统(棱镜分光),以光电管接收透过 光并经放大后再输入检流计。以 721 型最为普及。 ⑶紫外分光光度计:以氘灯作为光源,如核酸分析仪。必须使用石英比色皿。 ④紫外与可见光两种光学系统组合在一起。如 751、753、79、80 型等。以光栅分光、数 字显字吸光度(A)、透光度(T)并可转换成浓度(C)。有的还可附设打印系统。 ⑤半自动、全自动生化分析仪:从进样检测到发报告以及清洗均为微机控制程序。 ⑥原子吸收分光光度计:在燃气或高温条件下,样品原子化。其吸收特定波长的谱线后, 原子跃迁到激发态。(激发态原子返迁回基态时,又放出电磁波。)吸收光量的多少与原子化 的程度或样品的浓度有关。原子吸收分光光度计较普通分光光度计灵敏,主要用于检测微量 元素。 2.发射光谱分析 主要有火焰激发光谱分析和荧光光谱分析。 ⑴火焰激发光谱分析 原理:火焰使雾化样本产生原子化,外层电子跃迁到较高能级。此为激发态原子,极不 稳定,返迁回基态后,发射出特定的谱线,其强弱与样本中该元素的浓度相关。火焰光度法 主要用于人体常量元素,如 K +、Na+、Ca2+的检测。 仪器:火焰光度计 ⑵荧光不度分析法 原理:荧光物质在紫光到紫外光谱激发下发出波长较长的谱线(多为红色)发生荧光其强 弱与样本中荧光物质的浓度成正比。 仪器:荧光光度计、荧光分光光度计。最近国外研制出时间分辨免疫荧光光度技术和相 应的设备,把荧光检测技术推上一新的高度。 ⑶化学发光法采用化学发光仪检测化学反应中发出的光信号。 3.散射、透射光谱分析 原理:光线通过悬浊的介质溶液时,同时会发生反射、散射及透射现象,散射光强度与 溶液中混悬颗粒的量成正比,测量散射光强度用以分析样本中的待测成分,称散射光谱分析。 使用仪器为浊度计。如激光浊度计

测量透射光的强度,用以分析样品悬浊程度,为透射分析法。使用仪器为光电比色计和分光光度计。为了提高检测灵敏度,必须清除反射光的影响。故要求待测样品的颗粒直径小于入射波长,小于1/2者更佳。4.结果计算上述任一种分析法,测得结果仅表示相对的光谱学测定值(透光度、吸光度、发射光强度等)要计算成样品中成份的含量。(1)参比法:采用标准品与样品同时检测,计算结果。①单一标准法:采用单一浓度的标准品。原理:根据Beer定律推导出未知样品浓度的计算公式Au/As=Cu/CsCu=Au. Cs/As注:Au、As分别为未知样品和标准品的吸光度:Cu、Cs分别为未知样品和标准品的浓度。上述结果再乘以样品稀释倍数,即可得样品中该成份的实际含量。可写成:Cu=(Au/As).Cs. (V/v)v为样品的实际检测量容积V为所求测的样品的量或容积。②系列标准法实际工作中,由于多种因素(如反应物或试剂的浓度、溶解度及仪器的线性范围等限制),吸光度A与反应物浓度C不完全成正比例。此时,需用系列梯度浓度的标准液、绘制成标准曲线,以确定不同A值范围时的样品含量。制得的标准曲线,若高值范围曲线趋向低平,不宜采用,此高值样品需稀释后重测,否则误差较大。(2)吸光率法①单一呈成分据Lambert--Beer氏定律A=KCL,当L不变时,A与C成正比。此处K值即为该呈色物质的吸光率。运用已知K值(以摩尔吸光率ε),可根据A值计算浓度C。② C=A / 8摩尔吸光率的定义:1摩尔浓度的呈色物质,在一定温度和光径1cm时的吸光度值。在实际工作中,有些实验嫌摩尔吸光率过大,可采用毫摩尔和微摩尔吸光率。其函义类推。例举氰化高铁血红蛋白(HiCN)测定:a.测定注HiCN浓度(mo1/L)=A540/(44X1.0)b.样本HiCN浓度(mo1/L)=A540X251/(44×1.0)注:A540HiCN测定注540nm处吸光度值251样本稀释倍数44HiCN毫摩尔吸光率1.0比色杯光径64458Hb分子量1000毫克转化成克②多种呈色成分共存时的检测及计算设a、b两成分在波长入境1擦时,摩尔吸光分别为εal及8bl:在波长入2时,摩尔吸光值分别是εa2及bl;a和b混合液在入1的吸光度为Al,在入2时的吸光度为A2。那么a、b二成分的各自浓度Ca和Cb。③非呈色成分测定4
4 测量透射光的强度,用以分析样品悬浊程度,为透射分析法。使用仪器为光电比色计和 分光光度计。 为了提高检测灵敏度,必须清除反射光的影响。故要求待测样品的颗粒直径小于入射波 长,小于 1/2 者更佳。 4.结果计算 上述任一种分析法,测得结果仅表示相对的光谱学测定值•(透光度、吸光度、发射光强 度等)要计算成样品中成份的含量。 ⑴参比法:采用标准品与样品同时检测,计算结果。 ①单一标准法:采用单一浓度的标准品。 原理:根据 Beer 定律推导出未知样品浓度的计算公式: Au/As=Cu/Cs Cu=Au.Cs/As 注:Au、As 分别为未知样品和标准品的吸光度; Cu、Cs 分别为未知样品和标准品的浓度。 上述结果再乘以样品稀释倍数,即可得样品中该成份的实际含量。可写成: Cu=(Au/As).Cs.(V/v) v 为样品的实际检测量容积 V 为所求测的样品的量或容积。 ②系列标准法 实际工作中,由于多种因素•(如反应物或试剂的浓度、溶解度及仪器的 线性范围等限制)•,吸光度 A 与反应物浓度 C 不完全成正比例。此时,需用系列梯度浓度的 标准液、绘制成标准曲线,以确定不同 A 值范围时的样品含量。制得的标准曲线,若高值范 围曲线趋向低平,不宜采用,此高值样品需稀释后重测,否则误差较大。 ⑵吸光率法 ① 单一呈成分据 Lambert-Beer 氏定律 A=KCL, 当 L 不变时,•A 与 C 成正比。••此 处 K 值即为该呈色物质的吸光率。运用已知 K 值(以摩尔吸光率ε)•,可根据 A 值计 算浓度 C。 ② C=A /ε 摩尔吸光率的定义:1 摩尔浓度的呈色物质,在一定温度和光径 1cm 时的吸光度值。 在实际工作中,有些实验嫌摩尔吸光率过大,可采用毫摩尔和微摩尔吸光率。其函义类 推。例举氰化高铁血红蛋白(HiCN)测定: a.测定注 HiCN 浓度(mol/L)=A540/(44 × 1.0) b.样本 HiCN 浓度(mol/L)=A540×251/(44 × 1.0) 注:A540 HiCN 测定注 540nm 处吸光度值 251 样本稀释倍数 44 HiCN 毫摩尔吸光率 1.0 比色杯光径 64458Hb 分子量 1000 毫克转化成克 ②多种呈色成分共存时的检测及计算 设 a、b 两成分在波长λ攬 1 攭时,摩尔吸光分别为εa1 及εb1;在波长λ2 时,摩尔 吸光值分别是εa2 及εb1;a 和 b 混合液在λ1 的吸光度为 A1,在λ2 时的吸光度为 A2。那 么 a、b 二成分的各自浓度 Ca 和 Cb。 ③非呈色成分测定

某些非呈色成分,当其具有特定的吸收波长时亦可采用吸光率法测定。如蛋白质(因含酪氨酸、色氨酸和苯丙酸的芳香族结构)和核酸(由嘌呤环和嘧啶环的共轭双键特性而决定)都具有对紫外光的吸收性质。前者吸收峰值为280mm。下列任一经验公式,都可用来计算蛋白质浓度。a.Lowry-Kalchar公式蛋白质(mg/ml)=1.45XA280-0.74XA260b.Warburg-Christian公式蛋白质(mg/ml)=1.55×A280-0.76XA260同样,可根据260mm吸光度值,计算核酸溶液的浓度。含蛋白微量时,不致影响;若含蛋白较多时,影响较大。通常规定:在260mm波长下,每毫升含1微克DNA溶液的吸光度值为0.020:而每毫升含1微克RNA溶液的吸光度值为0.022。由于不同蛋白质的酪氨酸和色氨酸含量差异较大,故不能准确定量,有主张选择200~225mm波段,因为以波段的光吸收主要与肽键有关。其经验公式是:蛋白质(g/L)=144×(A215-A225)此公式适用条件是样品经154mmo1/LNaC1作较高倍数的稀释。(二)层析分析层析(Chromatography),也称色谱。源于本世纪初。将多种植物色素注入吸附柱,经流动洗脱后,呈彩色的谱带排列而称之。然而,无色物质也同样可以在术上分离,故亦称为层析。1.层析原理层析不进利用不同物质的理化性质的差异进行物质分离的技术。层折系统由两个相组成:一是固定相,为固体物质或固定于固体物质上的成分。另一是流动相,为可以流动的物质,当待分离混合物随流动相通过固定相区域时,各级分的理化性质存在差异,与两相相互作用的能力(如吸附、溶解、结合等)不同,在两相中的分配比例不相同,随动相移动时受到阻滞作用不相同,导致前移速度存在有差异,分部收集流出液,即可得到混合样品中的各单一组分。2.层析分类(1)按流动相性状:液相层析和气相层析。(2)按操作方式:柱层析、纸层析和薄层层析。(3)按分离原理:吸附层析、分配层析、离子交换层析、亲和层析和凝胶层析。3.(1)分配层析分配层析是利用混合物在两种或两种以上的溶剂中分配系数不同而使物质分离的方法。相当于一种连续性的溶剂抽提法。例如纸层析,滤纸是载体,水是液相固定相:有机溶剂则为液相流动相。被分离成分在水与有机溶剂间的分配系数不同而移动速度有差别,得以分离。移动速度可用比移值(RF)表示。色斑中心至原点中心距离RF=溶剂前沿至原点中心距离纸层析有垂直和水平二型。垂直型是将滤纸悬起,使流动相向上或向下扩散:水平型是流动相向四周扩散。垂直型较为常用。单向层析:在垂直型层析中,流动相只向一个方向层析。双向层析:分析系数相近的物质,单向层析不易分离。此时,将滤纸快速吹干,转90°方向作第二次层析。双向层析可提高层析分离的效果。5
5 某些非呈色成分, 当其具有特定的吸收波长时亦可采用吸光率法测定。 如蛋白质(因含 酪氨酸、色氨酸和苯丙酸的芳香族结构)•和核酸(由嘌呤环和嘧啶环的共轭双键特性而决定) 都具有对紫外光的吸收性质。前者吸收峰值为 280mm。下列任一经验公式,都可用来计算蛋 白质浓度。 a.Lowry-Kalchar 公式 蛋白质(mg/ml)=1.45×A280-0.74×A260 b.Warburg-Christian 公式 蛋白质(mg/ml)=1.55×A280-0.76×A260 同样, 可根据 260mm 吸光度值,计算核酸溶液的浓度。含蛋白微量时,不致影响;若含 蛋白较多时, 影响较大。通常规定:在 260mm 波长下,每毫升含 1 微克 DNA 溶液的吸光度值 为 0.020;而每毫升含 1 微克 RNA 溶液的吸光度值为 0.022。 由于不同蛋白质的酪氨酸和色氨酸含量差异较大,故不能准确定量,有主张选择 200~ 225mm 波段,因为以波段的光吸收主要与肽键有关。其经验公式是: 蛋白质(g/L)=144×(A215-A225) 此公式适用条件是样品经 154mmol/LNaCl 作较高倍数的稀释。 (二)层析分析 层析(Chromatography),也称色谱。源于本世纪初。将多种植物色素注入吸附柱,经流 动洗脱后,呈彩色的谱带排列而称之。然而,无色物质也同样可以在术上分离,故亦称为层 析。 1.层析原理 层析不进利用不同物质的理化性质的差异进行物质分离的技术。层折系统由两个相组成: 一是固定相,为固体物质或固定于固体物质上的成分。另一是流动相,为可以流动的物质, 当待分离混合物随流动相通过固定相区域时,各级分的理化性质存在差异,与两相相互作用 的能力(如吸附、溶解、结合等)不同,在两相中的分配比例不相同,随动相移动时受到阻滞 作用不相同,导致前移速度存在有差异,分部收集流出液,即可得到混合样品中的各单一组 分。 2.层析分类 (1)按流动相性状:液相层析和气相层析。 (2)按操作方式:柱层析、纸层析和薄层层析。 (3)按分离原理:吸附层析、分配层析、离子交换层析、亲和层析和凝胶层析。 3. (1)分配层析 分配层析是利用混合物在两种或两种以上的溶剂中分配系数不同而使物质分离的方法。 相当于一种连续性的溶剂抽提法。例如纸层析,滤纸是载体,水是液相固定相:有机溶剂则 为液相流动相。被分离成分在水与有机溶剂间的分配系数不同而移动速度有差别,得以分离。 移动速度可用比移值(RF)表示。 色斑中心至原点中心距离 RF= ──────────── 溶剂前沿至原点中心距离 纸层析有垂直和水平二型。垂直型是将滤纸悬起,使流动相向上或向下扩散;水平型是 流动相向四周扩散。垂直型较为常用。 单向层析:在垂直型层析中,流动相只向一个方向层析。 双向层析:分析系数相近的物质,单向层析不易分离。此时,将滤纸快速吹干,转 90° 方向作第二次层析。双向层析可提高层析分离的效果

(2)吸附层析氧化铝、硅胶等固相吸附剂,具有吸时其他一些物质的性质。借吸附力差异将混合物分离。吸时力的强弱,不但取决于吸附剂,也与被分离物质有关。吸附层析有柱层析和薄层层析两种。①柱层析:在一支玻璃管下端垫以棉花或玻璃棉。装入吸附剂。用一种溶剂润湿后,在顶部加入样品溶液。在样品进入吸附剂层并形成色圈后,即加入合适的洗脱液。样品中被分离的成分,随着洗脱液下移,因各成分吸附系数不同而得以分离。在洗脱过程中,柱内发生溶解--吸附--再溶解--再吸附-再溶解..·.连续下行过程。吸附系数小的成分容易洗脱,吸附系数大的成分洗脱较慢。样品若为有色成分,则可将吸附柱(剂)从管中顶出,切割下来再分析。现多采用连续加入溶剂,连续分部收集洗脱剂的方法。此尤其适用于无色成分的分离。非极性或极性较弱的有机物质,如葫萝卜素、甘油脂及磷脂等,最适用吸附层析法分离。②薄层层析将吸附剂平铺在玻璃(片)上,分为硬板(加粘合剂)和软板(不加粘合剂)两种。前者制备复杂些,但易保存:后者制备虽简单,吹干时却易散开。通常,是用吸附剂氧化铝G或硅胶G制成硬板(G表示石膏,通常含量为5%),淀粉、羧甲基纤维素纳(CMC)也可作粘合剂制板。(3)离子交换层析离子交换层析的固定相是离子交换剂,利用离子交换剂对需要分离的各种离子有不同的亲和力,使离子在层析柱中移行时达到分离的目的。离子交换层析在柱中进行,由骨架和离子交换基团构成。交换基团为酸性,可与溶液中的阳离子交换,称阳离子交换剂:反之,称阴离子交换剂。常用交换剂如表3。表3常用交换基及类型骨架交换基酸碱性类型树脂强酸性磺酸基(-SO3H)阳离子型纤维素酚羟基(-OH)强酸性阳离子型弱葡聚糖羧基(-COOH)酸性阳离子型季胺基(-NR3OH)强碱性阴离子型性伯胺基(-NH2)弱碱阴离子型弱碱性促胺基(-NHR)阴离子型弱碱性叔胺基(-NR2)阴离子型交换反应例举如下:+HXR-S03H+MX++R-S03-MR4NON+HXR4NX+HOH虽然交换反应都是平衡反应,但在层析柱上进行时,由于交换溶液连续更新,反应朝向正反应进行,直至完全。(4)凝胶层析凝胶有天然(如琼脂糖)和人工合成(如葡聚糖等)两类。凝胶具有网络结构。控制其浓度和交联度,即可控制其网络的孔径。凝胶产品为颗粒状,小分子物质因易进入颗粒的内部网络,洗脱时,流出时间较长,称阻滞较大:大分子物质不能进入网络内,从而经颗粒间隙而流出。途径短,流出时间短,称阻滞小。因能按分子大小将混合物质分离,故也称凝胶过滤或分子筛层析。6
6 (2)吸附层析 氧化铝、硅胶等固相吸附剂,具有吸咐其他一些物质的性质。借吸附力差异将混合物分 离。吸咐力的强弱,不但取决于吸附剂,也与被分离物质有关。吸附层析有柱层析和薄层层 析两种。 ①柱层析:在一支玻璃管下端垫以棉花或玻璃棉。装入吸附剂。用一种溶剂润湿后,在 顶部加入样品溶液。在样品进入吸附剂层并形成色圈后,即加入合适的洗脱液。样品中被分 离的成分,随着洗脱液下移,因各成分吸附系数不同而得以分离。 在洗脱过程中, 柱内发生溶解-吸附-再溶解-再吸附-再溶解.连续下行过程。 吸附系数小的成分容易洗脱,吸附系数大的成分洗脱较慢。样品若为有色成分,则可将吸附 柱(剂)从管中顶出,切割下来再分析。现多采用连续加入溶剂,连续分部收集洗脱剂的方法。 此尤其适用于无色成分的分离。非极性或极性较弱的有机物质,如葫萝卜素、甘油脂及磷脂 等,最适用吸附层析法分离。 ②薄层层析 将吸附剂平铺在玻璃(片)上,分为硬板(加粘合剂)和软板(不加粘合剂)两种。前者制备 复杂些,但易保存;后者制备虽简单,吹干时却易散开。通常,是用吸附剂氧化铝 G 或硅胶 G 制成硬板(G 表示石膏,通常含量为 5%)•,淀粉、羧甲基纤维素纳(CMC)也可作粘合剂制板。 (3)离子交换层析 离子交换层析的固定相是离子交换剂,利用离子交换剂对需要分离的各种离子有不同的 亲和力,使离子在层析柱中移行时达到分离的目的。 离子交换层析在柱中进行,由骨架和离子交换基团构成。交换基团为酸性,可与溶液中 的阳离子交换,称阳离子交换剂;反之,称阴离子交换剂。常用交换剂如表 3。 表 3 常用交换基及类型 ────────────────────────────── 骨 架 交 换 基 酸 碱 性 类 型 ────────────────────────────── 树 脂 磺酸基(-SO3H) 强 酸 性 阳离子型 纤维素 酚羟基(-OH) 强 酸 性 阳离子型 葡聚糖 羧 基(-COOH) 弱 酸 性 阳离子型 季胺基(-NR3OH) 强 碱 性 阴离子型 伯胺基(-NH2) 弱 碱 性 阴离子型 促胺基(-NHR) 弱 碱 性 阴离子型 叔胺基(-NR2) 弱 碱 性 阴离子型 ────────────────────────────── 交换反应例举如下: R-SO3 - H + M+ X R-SO3-M + + H+ X - R4 N+ ON- + H+ X R4 N+ X - + H+ OH- 虽然交换反应都是平衡反应,但在层析柱上进行时,由于交换溶液连续更新,反应朝向 正反应进行,直至完全。 (4)凝胶层析 凝胶有天然(如琼脂糖)和人工合成(如葡聚糖等)两类。凝胶具有网络结构。控制其浓度 和交联度,即可控制其网络的孔径。凝胶产品为颗粒状,小分子物质因易进入颗粒的内部网 络,洗脱时,流出时间较长,称阻滞较大:大分子物质不能进入网络内,从而经颗粒间隙而 流出。途径短,流出时间短,称阻滞小。因能按分子大小将混合物质分离,故也称凝胶过滤 或分子筛层析

凝胶层析中儿个技术问题。①凝胶的选择:a.载体必须是惰性,化学性质稳定。b.尽可能低电荷,以防止与溶质发生离子交换。C.机械强度好,不易变形。②凝胶用量:与层析柱大小有关。柱的直径与高度之比,一般是1:10至1:20。若被分离物质的分子量比较接近,则宜选用较细长的柱子(1:100或更大)。③凝胶制备:商品凝胶是干燥的颗粒,使用前应使其充分溶胀。可采用自然溶胀,即室温浸泡一昼夜:亦可在沸水中,将凝胶逐渐长温至沸。通常仅需1~2小时。热法溶胀的另一优点是消毒杀菌及除去凝胶中的气泡。装柱:要求均匀一致,无气泡和纹路。可用大分子有色物质过柱。如蓝色葡聚糖,分子量为2×10°道尔顿,完全不进入孔内。可观察色带移动是否整齐。防腐:葡聚糖凝胶都是多糖物质,细菌极易生长,可使糖苷键水解,故须加入防腐剂。所选用防腐剂也必须是情性、化学性稳定的,不会使凝胶和溶质发生变性,不会使凝胶色泽发生改变,而且尽可能不吸收紫外光。常用防腐剂有:叠氮钠(使用浓度为0.2克/L)及苯基代汞盐(使用浓度为0.05~0.1克,在碱性溶液中抑菌效果较差)。(5)亲和层析生物体内某些高分子化合物,对与其结构相匹配的化合物具有专一性亲和的特性。如酶与底物,抗原与抗体,DNA和互补DNA或RNA,外凝集亲与细胞膜糖蛋白等。利用这一特性进行物质分离的层析技术称为亲和层析。亲和物:指亲和吸附的双方。配基:以共价键与载体链接的亲和物,亲和物双方都可以作为配基,通常是选用小分子者,如辅基、酶抑制剂。载体:结合配基的固相、如琼脂糖凝胶、聚丙烯酰胺凝胶和多孔玻璃珠等。采用凝胶的衍生物如氨基琼脂糖、溴乙酰琼脂糖及琉基琼脂糖等,可减小位阻作用,效果更好。亲和物的结合和洗脱,决定于反应条件。选择适合的PH和离子强度,再将待测成分洗脱。亲和层析多用于蛋白质的分离和纯化。如酶蛋白及甲胎蛋白的纯化也可用于核酸品的分离。(6)高压液相层析见高新技术。(7)气相层析以气体为流动相,分气一一气和气一一液层析两种,后者常用。流动相气体必须是情性。常用氢气、氮气、氨氮气等作为载气,固定相是选用高沸点的有机化合物均匀包裹在担体上,对样本的要求则必须是气态或者进柱后很快变成气态。样品进柱后,立即溶于固定相,遇热双挥发扩散入载气。随着氮气的流动又溶解一挥发,再溶解一再挥发,如此交替进行。样品组分借分配系数不同得以分离。气相层析发展很快,已成为一门独立的分离分析技术。(三)电泳法带有电荷的粒子,在电场中移动的现象,称为电泳(electrophoresis)。1937年Tiselius利用U型管进行血清蛋白电泳,依据蛋白质与溶液所形成界面的折射率差异,发现血清蛋白质可分成五个区带。此属自由界面电泳。1948年,Wieland和Konig用滤纸为支技物,使电泳技术大为简化,从而在临床广泛使用。后又发展为琼脂凝胶电泳(1950),淀粉胶电泳(1955),聚丙烯酰胺凝胶电泳(1959)以及现时广泛应用的醋酸纤维素薄膜电泳。此外,更有等电聚焦、双向电泳等技术出现,为生物化学实验研究,提供了新的手段。1.基本原理Stoke定律:一球形粒子运动时,所受到阻力F与粒子运动速度V、粒子半径r,以及介质的粘度n的关系为:F"=6nrnv7
7 凝胶层析中几个技术问题。 ①凝胶的选择:a.载体必须是惰性,化学性质稳定。b.尽可能低电荷,以防止与溶质发 生离子交换。c.机械强度好,不易变形。 ②凝胶用量:与层析柱大小有关。柱的直径与高度之比,一般是 1:10 至 1:20。若被分 离物质的分子量比较接近,则宜选用较细长的柱子(1:100 或更大)。 ③凝胶制备:商品凝胶是干燥的颗粒,使用前应使其充分溶胀。可采用自然溶胀,即室 温浸泡一昼夜;亦可在沸水中,将凝胶逐渐长温至沸。通常仅需 1~2 小时。热法溶胀的另一 优点是消毒杀菌及除去凝胶中的气泡。 ④装柱:要求均匀一致,无气泡和纹路。可用大分子有色物质过柱。如蓝色葡聚糖,分 子量为 2×10 6 道尔顿,完全不进入孔内。可观察色带移动是否整齐。 ⑤防腐:葡聚糖凝胶都是多糖物质,细菌极易生长,可使糖苷键水解,故须加入防腐剂。 所选用防腐剂也必须是惰性、化学性稳定的,不会使凝胶和溶质发生变性,不会使凝胶色泽 发生改变,而且尽可能不吸收紫外光。常用防腐剂有:叠氮钠•(使用浓度为 0.2 克/L)及苯基 代汞盐(使用浓度为 0.05~0.1 克,在碱性溶液中抑菌效果较差)。 (5)亲和层析 生物体内某些高分子化合物,对与其结构相匹配的化合物具有专一性亲和的特性。如酶 与底物, 抗原与抗体,DNA 和互补 DNA 或 RNA,外凝集亲与细胞膜糖蛋白等。利用这一特性 进行物质分离的层析技术称为亲和层析。 亲和物:指亲和吸附的双方。 配基:以共价键与载体链接的亲和物,亲和物双方都可以作为配基,通常是选用小分子 者,如辅基、酶抑制剂。 载体:结合配基的固相、如琼脂糖凝胶、聚丙烯酰胺凝胶和多孔玻璃珠等。采用凝胶的 衍生物如氨基琼脂糖、溴乙酰琼脂糖及巯基琼脂糖等,可减小位阻作用,效果更好。 亲和物的结合和洗脱,决定于反应条件。选择适合的 PH 和离子强度,再将待测成分洗脱。 亲和层析多用于蛋白质的分离和纯化。如酶蛋白及甲胎蛋白的纯化也可用于核酸品的分离。 (6)高压液相层析 见高新技术。 (7)气相层析 以气体为流动相,分气-气和气-液层析两种,后者常用。流动相气体必须是惰性。常 用氢气、氮气、氦气等作为载气,固定相是选用高沸点的有机化合物均匀包裹在担体上,对 样本的要求则必须是气态或者进柱后很快变成气态。样品进柱后,立即溶于固定相,遇热双 挥发扩散入载气。随着氤气的流动又溶解一挥发,再溶解一再挥发,如此交替进行。样品组 分借分配系数不同得以分离。气相层析发展很快,已成为一门独立的分离分析技术。 (三)电泳法 带有电荷的粒子, 在电场中移动的现象,称为电泳•(electrophoresis)•。1937 年 Tiselius 利用 U 型管进行血清蛋白电泳, 依据蛋白质与溶液所形成界面的折射率差异,发 现血清蛋白质可分成五个区带。此属自由界面电泳。1948 年,Wieland 和 Konig 用滤纸为支 技物, 使电泳技术大为简化, 从而在临床广泛使用。••后又发展为琼脂凝胶电泳(1950), 淀粉胶电泳(1955),聚丙烯酰胺凝胶电泳(1959)以及现时广泛应用的醋酸纤维素薄膜电泳。 此外,更有等电聚焦、双向电泳等技术出现,为生物化学实验研究,提供了新的手段。 1.基本原理 Stoke 定律:一球形粒子运动时,所受到阻力 F'与粒子运动速度 V、粒子半径 r,以及介 质的粘度 η 的关系为:F’= 6лrηv

设电场中带电粒子所受到力F,其与F达到动态平衡时,F=F。而F取决于粒带电量Q及电场强度X,即F=QX则QX=6Jrnvv/x=Q/6vv/x表示单位电场强度(电势梯度)时的粒子运动速度,称为电泳迁移率μ。可见,迁移率取决于带电量,也受粒子的本身的因素(半径、分子量)及介质的因素影响。因而,在一定的介质条件下,粒子间带电量和分子量或密度的差异,可在电场中得以分离。电泳迁移率单位是:厘米“/秒/伏。含义为:在伏/厘米的电场强度下的粒子迁移度(厘米/秒)。2.影响电泳因素(1)电泳介质的PH:介质的PH影响粒子的带电量。以氨基酸为例,介质PH等于该氨基酸等电点时,则氨基酸是电中性:低于其等电点时,带正电:高于其等电点时,带负电。蛋白质由氨基酸组成,蛋白质颗粒在某一PH的介质中的荷电性,取决于各种氨基酸的组成,亦即取决于等电点。为使介质PH恒定,介质由缓冲液组成。2)缓冲液的离子强度:离子强度过低,缓冲容量小,不易维持PH恒定;离子强度过高,降低了zeta电势(两相之间运动平面两侧的电位差,特指电泳中越过带电粒子切变表面的电应)。而使电泳速度减慢。常用离子强度应在0.02~0.2之间。缓冲液的离子强度计算如下μ=1/22cizi式中u为离子强度,Ci为某离子的摩尔浓度,Zi为某离子的价数。例:0.154mo1/LNaC1溶液之离子强度计算:μ=1/2(0.154×12+0.154X1)=0.154(3)电场强度:即每厘米距离的电势差,以伏/厘米表示。电场强度与带电粒子移动距离成正比。增加电场强度,带电粒运动加快,但电压也升高,产热增加,致缓冲液蒸以快,影响电泳迁移速率。故高压电泳需备冷却装置。为获得满意的电泳结果,电场强度的选择尤为重要。通常,醋纤薄膜电泳的电压选择为8~10V/cm。此系指两极间的平均电压,即仪表指示的电压除以两极间的距离。更准确者,应是用电流(伏)表测支持物两端的电压,然后计算电场强度。凝胶柱状(圆盘)电泳,则通常是计算每支凝胶管的电流(mA)来控制电场强度。(4)电渗:电场中,液体对于固体支持物作相对运动现象称为电渗electro-osmosis),水是极性分子,其解离后,实际上是以水合离子(Hso)和OH形式存在。通常,支持物(如滤纸)是多羟基化合物,呈电负性,使H30+吸附于其表面而形成一带电层。在电场中,H3+向负极移动,亦即为水在支持物表面的移动。电渗影响带电质粒移动速度(加快或减慢),但不影响区带分离。琼脂和滤纸肯有较大电渗作用,而醋酸纤素和聚丙烯酰胺凝胶则电渗很弱,几无电渗作用。(5)支持物:支持物对电泳的影响,除电渗作用外,尚有吸附和分子筛作用。前者不仅影响迁移速度,而且影响各组分测定的准确性。如血清蛋白纸电泳法,白蛋白偏低,即是滤纸的吸附作用导致尾遗现象:分子筛作用是因为某些支持物具有网络结构,而使分子量不同的组分迁移速度不同。3.常用支持物及电泳技术简介(1)醋酸纤维素薄膜电泳8
8 设电场中带电粒子所受到力 F,其与 F'达到动态平衡时,F=F'。而 F 取决于粒带电量 Q 及电场强度 X,即 F=QX 则 QX= 6лrηv v/x=Q/6лrηv v/x 表示单位电场强度(电势梯度)•时的粒子运动速度,称为电泳迁移率μ。可见,迁移 率取决于带电量,也受粒子的本身的因素(半径、分子量)及介质的因素影响。因而,在一定 的介质条件下,粒子间带电量和分子量或密度的差异,可在电场中得以分离。 电泳迁移率单位是:厘米 2 /秒/伏。含义为:在伏/厘米的电场强度下的粒子迁移度(厘 米/秒)。 2.影响电泳因素 (1)•电泳介质的 PH:介质的 PH 影响粒子的带电量。以氨基酸为例,介质 PH 等于该氨基 酸等电点时,则氨基酸是电中性;低于其等电点时,带正电;高于其等电点时,带负电。蛋 白质由氨基酸组成,蛋白质颗粒在某一 PH 的介质中的荷电性,取决于各种氨基酸的组成,亦 即取决于等电点。为使介质 PH 恒定,介质由缓冲液组成。 (2)•缓冲液的离子强度:离子强度过低,缓冲容量小,不易维持 PH 恒定;离子强度过高, 降低了 zeta 电势•(两相之间运动平面两侧的电位差,特指电泳中越过带电粒子切变表面的电 位)。而使电泳速度减慢。常用离子强度应在 0.02~0.2 之间。缓冲液的离子强度计算如下: µ= 1/2ΣciZi2 式中μ为离子强度,Ci 为某离子的摩尔浓度,Zi 为某离子的价数。 例:0.154mol/LNaCl 溶液之离子强度计算: µ=1/2(0.154 ╳ 1 2 + 0.154╳ 1 2 ) = 0.154 (3)电场强度:即每厘米距离的电势差,以伏/厘米表示。电场强度与带电粒子移动距离 成正比。增加电场强度,带电粒运动加快,但电压也升高,产热增加,致缓冲液蒸以快,影 响电泳迁移速率。故高压电泳需备冷却装置。 为获得满意的电泳结果,电场强度的选择尤为重要。通常,醋纤薄膜电泳的电压选择为 8~10V/cm。 此系指两极间的平均电压,即仪表指示的电压除以两极间的距离。更准确者, 应是用电流(伏)表测支持物两端的电压,然后计算电场强度。凝胶柱状(圆盘)电泳,则通常 是计算每支凝胶管的电流(mA)来控制电场强度。 (4)• 电渗: 电场中 , 液 体 对 于 固 体 支 持 物 作 相 对 运 动 现 象 称 为 电 渗 ••(electro-osmosis)•,水是极性分子,其解离后,实际上是以水合离子(H3O + )和 OH-形式存 在。通常,支持物(如滤纸)是多羟基化合物,呈电负性,使 H3O+吸附于其表面而形成一带电 层。在电场中,H3+向负极移动,亦即为水在支持物表面的移动。 电渗影响带电质粒移动速度(加快或减慢),但不影响区带分离。琼脂和滤纸肯有较大电 渗作用,而醋酸纤素和聚丙烯酰胺凝胶则电渗很弱,几无电渗作用。 (5)•支持物:支持物对电泳的影响,除电渗作用外,尚有吸附和分子筛作用。前者不仅 影响迁移速度,而且影响各组分测定的准确性。如血清蛋白纸电泳法,白蛋白偏低,即是滤 纸的吸附作用导致尾遗现象;分子筛作用是因为某些支持物具有网络结构,而使分子量不同 的组分迁移速度不同。 3.常用支持物及电泳技术简介 (1)醋酸纤维素薄膜电泳

将醋酸纤维素溶于丙酮后制成,具有低电渗,吸附作用小的优点。操作简易,临床上使用十分普遍。如血清蛋白电泳,血红蛋白电泳等。(2)琼脂糖凝胶电泳琼指糖是D-半乳糖3,6-脱水-L-半乳糖相间结合的多糖,自天然琼脂中提取。由于电泳凝胶的浓度是3.5~5克/升。制胶容易,成本较低,可用于脂蛋白、DNA电泳等。(3)聚丙烯酰胺凝胶电泳聚丙烯酰胺凝胶是人工合成,除有一般电泳的电荷效应外,因呈网络结构而具有分子筛作用。其主要成分如表1。表 1 聚丙烯酰胺凝胶主要成分及作用分成作用单体丙烯酰胺甲叉双丙烯酰胺交联剂引发剂过硫酸铵或核黄素四甲基乙二胺或二甲基胺基丙晴加速剂注:核黄素只能与四甲基乙二胺配伍,为光聚合:过硫酸铵与两种加速剂可配伍使用,为化学聚合。凝胶形成机理引发剂提供自由基,使丙烯酰胺和双丙烯酰胺的不饱和键打开。在加速剂作用下,发生交联聚合。反应如下:CH2— CHCH2-CH-CH2CHCH2CHFCbNH2CONH2CONH2CONH2CH2CH2CONH2CONH2CONH2CONH2CHCH-CH2—CHCH2--CH2 -CHCH2 -丙烯酰胺甲叉双丙烯酰胺聚丙烯酰胺凝胶凝胶浓度与交联度凝胶浓度(T%):100ml溶液中,含有单体和交联剂(俗称干胶)的克数。其决定孔径的大小。交联度(C%):干胶中双丙烯酰胺占取的百分比例。交联度主要影响凝胶铁透明度和弹性。但当交联度达5%时,无论凝胶总浓度多大,孔径都是最小。根据被分离成分的分子量来选择凝胶浓度(见表2)表2凝胶浓度的选择T(%)被分离成分分子量<1063.75~7.0104~1067.5~15.0<10422.5~30.0聚丙烯酰胺凝胶可制备成柱状和板状两种电泳方式。柱状凝胶电泳也称园盘电泳。一是9
9 将醋酸纤维素溶于丙酮后制成,具有低电渗,吸附作用小的优点。操作简易,临床上使 用十分普遍。如血清蛋白电泳,血红蛋白电泳等。 (2)琼脂糖凝胶电泳 琼指糖是 D-半乳糖 3,6-脱水-L-半乳糖相间结合的多糖, 自天然琼脂中提取。由于电泳 凝胶的浓度是 3.5~5 克/升。制胶容易,成本较低,可用于脂蛋白、DNA 电泳等。 (3)聚丙烯酰胺凝胶电泳 聚丙烯酰胺凝胶是人工合成,除有一般电泳的电荷效应外,因呈网络结构而具有分子筛 作用。其主要成分如表 1。 表 1 聚丙烯酰胺凝胶主要成分及作用 ─────────────────────────── 成 分 作 用 ─────────────────────────── 丙烯酰胺 单 体 甲叉双丙烯酰胺 交联剂 过硫酸铵或核黄素 引发剂 四甲基乙二胺或二甲基胺基丙晴 加速剂 ─────────────────────────── 注:核黄素只能与四甲基乙二胺配伍,为光聚合;过硫酸铵与两种加速剂可配伍使用,为化 学聚合。 凝胶形成机理 引发剂提供自由基,使丙烯酰胺和双丙烯酰胺的不饱和键打开。在加速剂作用下,发生 交联聚合。反应如下: CH2 CH CH2 CH CH2 CH CH2 CH CONH2 CONH2 CONH2 CONH2 CH2 + CH2 CONH2 CONH2 CONH2 CONH2 CH2 CH CH2 CH CH2 CH CH2 CH 甲叉双丙烯酰胺 丙烯酰胺 聚丙烯酰胺凝胶 凝胶浓度与交联度 凝胶浓度(T%):100ml 溶液中,含有单体和交联剂(俗称干胶)的克数。其决定孔径的大 小。 交联度(C%)•:干胶中双丙烯酰胺占取的百分比例。交联度主要影响凝胶铁透明度和弹 性。 但当交联度达 5%时,无论凝胶总浓度多大,孔径都是最小。根据被分离成分的分子量 来选择凝胶浓度(见表 2) 表 2 凝胶浓度的选择 ─────────────────────────── 被分离成分分子量 T(%) ─────────────────────────── <106 3.75~7.0 104~106 7.5~15.0 <104 22.5~30.0 ─────────────────────────── 聚丙烯酰胺凝胶可制备成柱状和板状两种电泳方式。柱状凝胶电泳也称园盘电泳。一是

区带染色后呈园盘状而名;二是聚丙烯酰胺凝胶电泳是采用不连续缓冲体系(discontinousbuffersystem),“disc”是“不连续”一词的词头,凑巧也是园盘之意。因此,称柱状凝胶电泳为园盘电泳,既形象又符合实义。不连续缓冲体系,使聚丙烯酰胺凝胶电泳具有浓缩效应。4.电泳技术的应用(1)组分的定量分析:如血清蛋白电泳,观察各组分的比例变化,提示其临床意义。(2)纯度鉴定:化学提纯的产品是否纯,可用电泳法证明之。如牛血清白蛋白(BSA),通常以“电泳纯”表示其纯度(即电泳分析结果呈现一条白蛋白带)。(3)分子量测定,十二烷基硫酸钠(SDS)能与蛋白质结合,而且结合量与蛋白质分子量有关。十二烷基硫酸钠具有大量阴电荷,与蛋白结合后,使蛋白质之间的荷电量差异减少至可忽略。故电泳迁移率只与分子量有关。实验时,需用一组已知分子量的标准品(marker)与样品同时电泳,比较迁移距离而测知分子量。4)等电点测定:等电聚焦电泳是测定蛋白质等电点的精确方法(精确度可达0.01PH单位)。其原理是:在阳极聚集硫酸,在阴极聚集氢氧化钠,凝胶中加入两性电解质(商品名:Ampholin)。通电后,两性电解质即可解离并排列成一PH梯度。样品中组分,不论放在那个位置,都可朝向与本身等电点相同的区域运动,达到该区域后不再泳动,而且愈来愈聚集,故名为等电聚焦电泳。检测时需用已知等电点的标准物质同时平行电泳,以比较而测知。(5)免疫电泳:抗原、抗体都具有蛋白成分,可在电场中泳动。电泳法使抗原抗体反应更加明显。对流免疫电泳是利用琼脂具有较大的电渗作用。由于电渗作用方向与抗原、抗体泳动方向相反,而且水合正离子的泳速大于抗体的泳速大于抗体的泳速,小于抗原的泳速。电泳开始时抗体在前,抗原在后,经一定时间后二者在电场中相遇发生反应。还可以将样本先经电泳分离,然后在区带旁侧挖槽,注入相对应的抗原或抗体,进行免疫扩散。此是鉴定抗原或抗体的有效办法。火箭电泳是免疫电泳的典型实例。其是将抗体预先加入琼脂中制板,而后在板上打孔。孔中加入抗原进行电泳。随着抗原的向前泳动持续地与抗体反应,抗原含量越高,形成沉淀峰(形似火箭)越高。火箭电泳又发展为用同位素标记的饱和平衡法,亦称放射免疫自显影术,灵敏度大为提高。(6)DNA和RNA分析:DNA和RNA的分析也可采用电泳技术。电泳前,凝胶中导入化乙锭,电泳过程中,溴化乙锭不断嵌入DNA和RNA中,经紫外照射,嵌入DNA和RNA的溴乙锭发出荧光而证明DNA和RNA的存在。同时作标准分子量电泳,可测知样品DNA或RNA的分子量。也可将电泳后的DNA或RNA带吸印到硝酸纤维素上作杂交分析。[注](8)同工酶电泳:酶的本质是蛋白质。同工酶因各亚基组成的差异(原级同工酶),电泳迁移率有别而分离,再经化学呈色而识别。乳酸脱氢酶同工酶,肌酸激酶同工酶在临床上使用较普遍。[注]吸印杂交技术为1975年Southern氏首创,用于酶解后DNA分子的杂交实验,命名为Southernblot。两年后,Alwine等将其用于RNA研究,称为Northernblot。1979年Renarnd以及Towbin等,又将此技术发展到蛋白质的研究中,称为Westernbolt。(四)离心分析l.离心力(centrifugeforce)离心机运转时,离心管绕离心机转抽转动。转动的角速度为。离心管中的微粒也随之作同样的运动。若要保持微粒匀速园周运动,必须有一足够大小的向心力来维持。根据牛顿定律,微粒所受的向心力FF=ma=v o r?10
10 区带染色后呈园盘状而名; 二是聚丙烯酰胺凝胶电泳是采用不连续缓冲体系(discontinous buffer system),“disc”是“不连续”一词的词头,凑巧也是园盘之意。因此,称柱状凝胶 电泳为园盘电泳,既形象又符合实义。不连续缓冲体系,使聚丙烯酰胺凝胶电泳具有浓缩效 应。 4.电泳技术的应用 (1)组分的定量分析:如血清蛋白电泳,观察各组分的比例变化,提示其临床意义。 (2)纯度鉴定:化学提纯的产品是否纯,可用电泳法证明之。如牛血清白蛋白(BSA),通 常以“电泳纯”表示其纯度(即电泳分析结果呈现一条白蛋白带)。 (3)分子量测定,十二烷基硫酸钠(SDS)能与蛋白质结合,而且结合量与蛋白质分子量有 关。十二烷基硫酸钠具有大量阴电荷,与蛋白结合后,使蛋白质之间的荷电量差异减少至可 忽略。 故电泳迁移率只与分子量有关。 实验时,需用一组已知分子量的标准品(marker)与 样品同时电泳,比较迁移距离而测知分子量。 (4)等电点测定:等电聚焦电泳是测定蛋白质等电点的精确方法(精确度可达 0.01PH 单 位)。其原理是:在阳极聚集硫酸,在阴极聚集氢氧化钠,凝胶中加入两性电解质(商品名: Ampholin)•。通电后,两性电解质即可解离并排列成一 PH 梯度。样品中组分,不论放在那个 位置,都可朝向与本身等电点相同的区域运动,达到该区域后不再泳动,而且愈来愈聚集, 故名为等电聚焦电泳。检测时需用已知等电点的标准物质同时平行电泳,以比较而测知。 (5)•免疫电泳:抗原、抗体都具有蛋白成分,可在电场中泳动。电泳法使抗原抗体反应 更加明显。对流免疫电泳是利用琼脂具有较大的电渗作用。由于电渗作用方向与抗原、抗体 泳动方向相反,而且水合正离子的泳速大于抗体的泳速大于抗体的泳速,小于抗原的泳速。 电泳开始时抗体在前,抗原在后,经一定时间后二者在电场中相遇发生反应。 还可以将样本先经电泳分离,然后在区带旁侧挖槽,注入相对应的抗原或抗体,进行免 疫扩散。此是鉴定抗原或抗体的有效办法。 火箭电泳是免疫电泳的典型实例。其是将抗体预先加入琼脂中制板,而后在板上打孔。 孔中加入抗原进行电泳。随着抗原的向前泳动持续地与抗体反应,抗原含量越高,形成沉淀 峰(形似火箭)越高。火箭电泳又发展为用同位素标记的饱和平衡法,亦称放射免疫自显影术, 灵敏度大为提高。 (6)•DNA 和 RNA 分析:DNA 和 RNA 的分析也可采用电泳技术。电泳前,凝胶中导入溴化乙 锭,电泳过程中,溴化乙锭不断嵌入 DNA 和 RNA 中,经紫外照射,嵌入 DNA 和 RNA 的溴乙锭 发出荧光而证明 DNA 和 RNA 的存在。同时作标准分子量电泳,可测知样品 DNA 或 RNA 的分子 量。也可将电泳后的 DNA 或 RNA 带吸印到硝酸纤维素上作杂交分析。[注] (8)•同工酶电泳:酶的本质是蛋白质。同工酶因各亚基组成的差异(原级同工酶),电泳 迁移率有别而分离,再经化学呈色而识别。乳酸脱氢酶同工酶,肌酸激酶同工酶在临床上使 用较普遍。 [注]•吸印杂交技术为 1975 年 Southern 氏首创,用于酶解后 DNA 分子的杂交实验,命名 为 Southern blot。 两年后,Alwine 等将其用于 RNA 研究,称为 Northern blot。1979 年 Renarnd 以及 Towbin 等,又将此技术发展到蛋白质的研究中,称为 Western bolt。 (四)离心分析 1.离心力(centrifuge force) 离心机运转时,离心管绕离心机转抽转动。转动的角速度为ω。离心管中的微粒也随之 作同样的运动。若要保持微粒匀速园周运动,必须有一足够大小的向心力来维持。根据牛顿 定律,微粒所受的向心力 F: F=ma=vσrω 2
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《生物化学》课程教学资源(教案讲义)蛋白质的结构与功能.doc
- 《生物化学》课程教学资源(教案讲义)DNA的生物合成.doc
- 《生物化学》课程教学资源(教案讲义)糖代谢.doc
- 《生物化学》课程教学资源(教案讲义)细胞信息转导.doc
- 《生物化学》课程教学资源(文献资料)CURRICULUM FOR UNDER-GRADUATE MEDICAL EDUCATION IN BANGLADESH 2002.pdf
- 《生物化学》课程教学资源(文献资料)Harper’s Illustrated Biochemistry,26th edition,Robert K. Murray Daryl K. Granner Peter A. Mayes Victor W. Rodwell.pdf
- 《生物化学》课程教学资源(文献资料)Syllabus MBBS at the AIIMS(印度).pdf
- 《生物化学》课程教学资源(试卷习题)2012-护理本科-B卷-题目.doc
- 《生物化学》课程教学资源(试卷习题)2012级本科-B卷-题目.doc
- 《生物化学》课程教学资源(试卷习题)2012-护理本科-B卷-答案.doc
- 《生物化学》课程教学资源(试卷习题)2012级本科-B卷-答案.doc
- 《生物化学》课程授课教案(石河子大学:黄瑾).pdf
- 《生物化学》课程教学大纲 Biochemistry(五年制医学专业本科生使用).pdf
- 《病理学》课程教学资源(作业习题)传染病和寄生虫疾病(含答案).pdf
- 重庆医科大学:《病理学》课程教学资源(PPT课件)传染病与寄生虫病(infectious desease and parasitosis).ppt
- 《病理学》课程教学资源(作业习题)神经系统疾病(含答案).pdf
- 重庆医科大学:《病理学》课程教学资源(PPT课件)神经系统疾病(Diseases of the CNS).ppt
- 《病理学》课程教学资源(作业习题)内分泌系统疾病(含答案).pdf
- 重庆医科大学:《病理学》课程教学资源(PPT课件)内分泌系统疾病.ppt
- 《病理学》课程教学资源(作业习题)生殖系统和乳腺疾病(含答案).pdf
- 《生物化学》课程教学资源(文献资料)临床医本实验大纲 Biochemistry Experiment.doc
- 《生物化学》课程教学资源(文献资料)临床医本考试大纲.doc
- 《生物化学》课程教学资源(文献资料)Lehninger Principles of Biochemistry,5th EDITION,David L. Nelson、Michael M. Cox.pdf
- 《生物化学》课程PPT教学课件(留学生)Chapter 28 Vitamins.ppt
- 《生物化学》课程PPT教学课件(留学生)Chapter 10 Gluconeogenesis.ppt
- 《生物化学》课程PPT教学课件(留学生)Chapter 09 Tricarboxylic Acid Cycle.ppt
- 《生物化学》课程PPT教学课件(留学生)Chapter 33 Molecular Basis of Inherited Disease.ppt
- 《生物化学》课程PPT教学课件(留学生)Chapter 22 Amino acids - metabolism of carbon skeletons.ppt
- 《生物化学》课程PPT教学课件(留学生)Chapter 06 Bioenergetics and Oxidative Phosphorylation.ppt
- 《生物化学》课程PPT教学课件(留学生)Chapter 21 Amino acids - disposal of nitrogen.ppt
- 《生物化学》课程PPT教学课件(留学生)Chapter 07 Introduction of Carbohydrates.ppt
- 《生物化学》课程PPT教学课件(留学生)Chapter 15 glycosaminoglycans.ppt
- 《生物化学》课程PPT教学课件(留学生)Chapter 14 Metabolism of monosaccharides and disaccharides.ppt
- 《生物化学》课程PPT教学课件(留学生)Chapter 01 Amino Acids(structure of amino acid、acid/base properties of amino acid).ppt
- 《生物化学》课程PPT教学课件(留学生)Chapter 01 Amino Acids(overview).ppt
- 《生物化学》课程PPT教学课件(留学生)Chapter 31 Structure and Function of RNA.ppt
- 《生物化学》课程PPT教学课件(留学生)Chapter 20 The metabolism of cholesterol.ppt
- 《生物化学》课程PPT教学课件(留学生)Chapter 29 Metabolism of Nucleotides.ppt
- 《生物化学》课程PPT教学课件(留学生)Chapter 18 phospholipid metabolism.ppt
- 《生物化学》课程PPT教学课件(留学生)Chapter 19 glycolipid metabolism.ppt
