内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第五章 电解与库仑分析法 第三节 库仑滴定

第五章 一、库仑滴定 电解与库仑分析法 coulometric titration electrolytic and 二、自动库仑滴定 coulometric analysis automated coulometric titration 第三节 三、微库仑分析 库仑滴定 microcoulometric analysis coulometric titration 下一页
第五章 电解与库仑分析法 第三节 库仑滴定 一、库仑滴定 coulometric titration 二、自动库仑滴定 automated coulometric titration 三、微库仑分析 microcoulometric analysis electrolytic and coulometric analysis coulometric titration
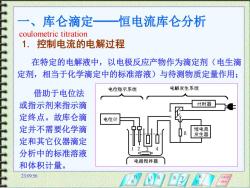
库仑滴定 恒电流库仑分析 coulometric titration 1.控制电流的电解过程 在特定的电解液中,以电极反应产物作为滴定剂(电生滴 定剂,相当于化学滴定中的标准溶液)与待测物质定量作用: 电解发生系统 借助于电位法 电位指示系统 或指示剂来指示滴 计时器 定终点。故库仑滴 电位计 定并不需要化学滴 恒电流 发生器 定和其它仪器滴定 分析中的标准溶液 电磁搅器 和体积计量。 23:0956
23:09:56 一、库仑滴定──恒电流库仑分析 coulometric titration 1. 控制电流的电解过程 在特定的电解液中,以电极反应产物作为滴定剂(电生滴 定剂,相当于化学滴定中的标准溶液)与待测物质定量作用; 借助于电位法 或指示剂来指示滴 定终点。故库仑滴 定并不需要化学滴 定和其它仪器滴定 分析中的标准溶液 和体积计量

2.库仑滴定的特点 (1)不必配制标准溶液 简便,简化了操作过程; (2)可实现容量分析中不易实现的滴定 Cu+、Br2、C12作为滴定剂; (3)滴定剂来自于电解时的电极产物 快速,产生后立即与溶液中待测物质反应; (4) 库仑滴定中的电量较为容易控制和准确测量 准确,可达0.2%; (5) 方法的灵敏度、准确度较高。 灵敏,可检测出物质量达10-5-109g/mL。基准物测定; 6) 可实现自动滴定 易自动化 23.0956
23:09:56 2.库仑滴定的特点 (1) 不必配制标准溶液 简便,简化了操作过程; (2) 可实现容量分析中不易实现的滴定 Cu+ 、Br2、Cl2作为滴定剂; (3) 滴定剂来自于电解时的电极产物 快速,产生后立即与溶液中待测物质反应; (4) 库仑滴定中的电量较为容易控制和准确测量 准确,可达0.2%; (5) 方法的灵敏度、准确度较高。 灵敏,可检测出物质量达 10-5-10-9 g/mL。基准物测定; (6) 可实现自动滴定 易自动化

3.库仑滴定的应用 (1)酸碱滴定 阳极反应:H,0=(1/2)02+2H++2e 阴极反应:2H,0=H2+20Ⅲ-2e 2)沉淀滴定 阳极反应:Ag=Ag+e (Pb=Pb2++2e) (3)配位滴定 阴极反应:HgY+2e=Hg+Y4 (4)氧化还原滴定 阳极反应:2Br=Br2+2e 2T=2+2e 230956
23:09:56 3.库仑滴定的应用 (1) 酸碱滴定 阳极反应:H2O = (1/2)O2+2H+ +2e 阴极反应:2 H2O =H2 +2OH- -2e (2) 沉淀滴定 阳极反应:Ag=Ag++e (Pb=Pb2++2e) (3) 配位滴定 阴极反应:HgY+2e = Hg+Y4- (4) 氧化还原滴定 阳极反应:2Br - = Br2+2e 2I- = I2+2e
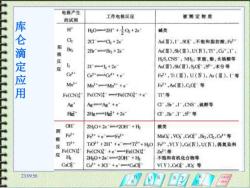
电极产生 的试剂 工作电板反应 孩测定物质 H 0一2H+0+2e 碱类 库仑滴定应用 C 20-C+2e" AdⅢ),1广,S0,不地和斯防酸,F2 阳Be 极 2Br+Br2 +2e Ad(重),Sb(Ⅲ),UN),TT,Cu,r 反 HS,CNS,NH,苯胺,酚,水畅酸等 应 2-h2+2e As(■),SⅢ),S0,S,水分等 Cett CeC+e F2,T(Ⅲ),U(N),A(Ⅲ),1广等 Mn3+ MnMn++e- F2,AⅢ),CCG等 Fe(CN) FCN)t→Fe(CNDB+e T1'等 Ag' Ag-Ag*+e C,B,CS,镜醇等 超 2gH6◆2e d,BT,等 OH 2H0+2e==20H+H 酸类 阴 F2+ 极 Fe+e一F2 MO,VO,CO,B,C2,Ce“等 反 THt TO+2H'+eT+HO F3·,V(V),C(W),U(W),偶氮染料 Fe(CN) Zt第 应 Fe(CN)+e-Fe(CN) 2H0+2e=20附+地 不饱和有机化合物等 Cuci- G+30-+e=CC V(V),CC,IO方等 23.0956 首
23:09:56 库 仑 滴 定 应 用

二、 自动库仑滴定 automated coulometric titration 1. 钢铁试样中含碳量的自动库仑测定 原理:试样在1200。C左右燃烧,产生的C0,导入高氯 酸钡酸性溶液,发生如下反应: Ba(CIO4)2+H,0+CO2→BaC03↓+2HCIO4 反应后溶液的酸度增加,开始电解,产生一定量OH 2H20+2e→20H+H2 (阴极反应) 溶液恢复到原来酸度值时,停止电解。 消耗的电量→产生的OH量→中和的HCIO4量 二摩尔的高氯酸相当于一摩尔的碳。 可由仪器读数装置直接读出含碳量。 23:0956
23:09:56 二、自动库仑滴定 automated coulometric titration 1. 钢铁试样中含碳量的自动库仑测定 原理:试样在1200 °C左右燃烧,产生的CO2导入高氯 酸钡酸性溶液,发生如下反应: Ba(ClO4 ) 2 + H2O + CO2 → BaCO3↓ + 2HClO4 反应后溶液的酸度增加,开始电解,产生一定量OH - 2H2O +2e → 2OH- +H2 (阴极反应) 溶液恢复到原来酸度值时,停止电解。 消耗的电量→产生的OH - 量→中和的 HClO4量 二摩尔的高氯酸相当于一摩尔的碳。 可由仪器读数装置直接读出含碳量

2.污水中化学耗氧量的测定 化学耗氧量(COD)是评价水质污染程度的重要指标。 它是指1dm3水中可被氧化的物质(主要是有机化合物)氧化 所需的氧量。 基于库仑滴定法设计的COD测定仪原理: 用一定量的高锰酸钾标准溶液与水样加热反应后,剩余 的高锰酸钾的量,用电解产生的亚铁离子进行库仑滴定: 5Fe2++Mn04+8Ht=Mn2++5Fe3++4H,0 根据产生亚铁离子所消耗的电量,可确定溶液中剩余高 锰酸钾量,计算出水样的COD。 23.0956
23:09:56 2. 污水中化学耗氧量的测定 化学耗氧量(COD)是评价水质污染程度的重要指标。 它是指1dm3水中可被氧化的物质(主要是有机化合物)氧化 所需的氧量。 基于库仑滴定法设计的COD测定仪原理: 用一定量的高锰酸钾标准溶液与水样加热反应后,剩余 的高锰酸钾的量,用电解产生的亚铁离子进行库仑滴定: 5Fe2+ +MnO4 - +8H+ = Mn2+ +5Fe3+ +4H2O 根据产生亚铁离子所消耗的电量,可确定溶液中剩余高 锰酸钾量,计算出水样的COD
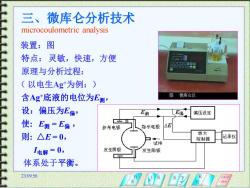
三、微库仑分析技术 microcoulometric analysis 装置:图 特点:灵敏,快速,方便 @0四a口g国g 000000-S 原理与分析过程: (以电生Ag为例:) 含Ag底液的电位为E测, 图微库仑仪 设:偏压为E偏, E测 卫偏 偏压设定 使:E测=E偏, 参考电极 指示电极 △E 则: △E=0, 放大 控制器 记录仪 试详 1电解=0, 发生阴极 发生阳极 体系处于平衡。 23:0956
23:09:56 三、微库仑分析技术 microcoulometric analysis 装置:图 特点: 灵敏,快速,方便 原理与分析过程: ( 以电生Ag+为例:) 含Ag+底液的电位为E测, 设:偏压为E偏, 使: E测 = E偏 , 则: △E = 0, I电解 = 0, 体系处于平衡
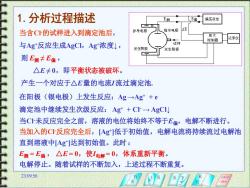
1.分析过程描述 E偏 偏压设定 当含C叶的试样进入到滴定池后, 参考电极 指示电极 么E 做大 控制器 记录 与Ag*反应生成AgCl,Ag浓度↓, 试样 发生阴极 发生阳极 则E测卡E偏, △E≠0,即平衡状态被破坏。 产生一个对应于△E量的电流流过滴定池, 在阳极(银电极)上发生反应:Ag→Ag+e 滴定池中继续发生次级反应:Ag+C→AgC 当C未反应完全之前,溶液的电位将始终不等于E偏,电解不断进行。 当加入的C反应完全后,[Ag低于初始值,电解电流将持续流过电解池 直到溶液中Ag]达到初始值。此时: E测=E偏,△E=0,使I电解=0,体系重新平衡。 电解停止。随着试样的不断加入,上述过程不断重复。 23.0956
23:09:56 1.分析过程描述 当含Cl-的试样进入到滴定池后, 与Ag+反应生成AgCl,Ag+浓度↓ , 则 E测 ≠ E偏 , △E ≠ 0,即平衡状态被破坏。 产生一个对应于E 量的电流I 流过滴定池. 在阳极(银电极)上发生反应:Ag →Ag+ + e 滴定池中继续发生次级反应: Ag+ + Cl- → AgCl↓ 当Cl-未反应完全之前,溶液的电位将始终不等于E偏,电解不断进行。 当加入的Cl-反应完全后,[Ag+ ]低于初始值,电解电流将持续流过电解池 直到溶液中[Ag+ ]达到初始值。此时: E测 = E偏 , △E = 0,使I电解 = 0,体系重新平衡。 电解停止。随着试样的不断加入,上述过程不断重复

2.卡尔.费休(Karl Fisher)法测定微量水 基本原理:利用1,氧化SO2时,水定量参与反应。 L2+S02+2H,0=2H+H,S04 以上反应为平衡反应,需要破坏平衡 卡尔费休试剂:由碘、吡啶、甲醇、 8888888 二氧化疏、水按一定比例组成。 (1)吡啶:中和生成的HⅡ 图微库仑仪 (2)甲醇:防止副反应发生 过程:电解产生碘 CsHsN·I2+CsH5N·SO2+CsH5N+2H20+ SO2 1ug水对应10.722毫 2 CsHsN·HI+CsHsN 库仑电量。 SO2 SO4CH3 CsHsN +HOCH3→ C:H:N 230956
23:09:56 2.卡尔․费休(Karl Fisher)法测定微量水 基本原理:利用I2 氧化SO2 时,水定量参与反应。 过程:电解产生碘 1g水对应10.722毫 库仑电量。 (1)吡啶:中和生成的HI (2)甲醇:防止副反应发生 I2+SO2+2H2O = 2HI+H2SO4 以上反应为平衡反应,需要破坏平衡. 卡尔‧费休试剂:由碘、吡啶、甲醇、 二氧化硫、水按一定比例组成
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第五章 电解与库仑分析法 第二节 库仑分析.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第五章 电解与库仑分析法 第一节 电解分析.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第四章 电位与电导分析法 第四节 电导分析法应用.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第四章 电位与电导分析法 第三节 电导分析法原理.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第四章 电位与电导分析法 第二节 电位分析法的应用.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第四章 电位与电导分析法 第一节 电位分析原理与离子选择电极.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第三章 电化学分析导论 第二节 化学电池与电极电位.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第三章 电化学分析导论 第一节 电化学分析法概述.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第二 章 计算机与仪器分析 第四节 人工智能与仿真模拟.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第二 章 计算机与仪器分析 第三节 信息处理与数据挖掘技术.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第二 章 计算机与仪器分析 第二节 数据采集与计算机控制.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第二 章 计算机与仪器分析 第一节 计算机与仪器分析.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第一章 绪论 第三节 课程内容与学习.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第一章 绪论 第二节 分类与进展.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第一章 绪论 第一节 概述 generalization.ppt
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第六章 分析化学中常用的分离方法(3/3)§6−4 离子交换分离法 §6-5 层析分离法 §6-6 其它分离方法简介.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第六章 分析化学中常用的分离方法(2/3)§6-3 溶剂萃取分离法.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第六章 分析化学中常用的分离方法(1/3)§6-1 概述 §6-2 沉淀分离法.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第八章 分析实验数据处理.pdf
- 吉林大学:《化学分析》课程教学资源(课件讲稿)第七章 吸光光度法.pdf
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第六章 极谱与伏安分析法 第一节 极谱分析基本原理.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第六章 极谱与伏安分析法 第二节 极谱定性定量方法与应用.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第六章 极谱与伏安分析法 第三节 现代极谱分析技术.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第六章 极谱与伏安分析法 第四节 溶出伏安分析原理与技术.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第七章 电化学分析专题及生物芯片 第一节 电化学专题.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第七章 电化学分析专题及生物芯片 第二节 生物芯片.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第八章 色谱分析基础 第一节 色谱法概述.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第八章 色谱分析基础 第二节 色谱理论基础.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第八章 色谱分析基础 第三节 定性定量方法.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第九章 气相色谱分析法 第一节 气相色谱仪.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第九章 气相色谱分析法 第二节 色谱固定相及其选择.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第九章 气相色谱分析法 第三节 气相色谱检测器.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第九章 气相色谱分析法 第四节 分离与操作条件选择.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第九章 气相色谱分析法 第五节 气相色谱分析法的应用.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第九章 气相色谱分析法 第六节 毛细管色谱法.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第十章 高效液相色谱分析法 第一节 高效液相色谱的特点与仪器.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第十章 高效液相色谱分析法 第二节 基本原理与主要分离类型.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第十章 高效液相色谱分析法 第三节 固定相与流动相.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第十章 高效液相色谱分析法 第四节 影响分离的因素与操作条件选择.ppt
- 内蒙古大学:《仪器分析化学》课程教学资源(PPT课件)第十章 高效液相色谱分析法 第五节 离子色谱法.ppt
