闽江学院:《分析化学》课程教学资源(PPT课件)第六章 吸光光度法

第六章 吸光光度法 1
1 第六章 吸 光 光 度 法

化学分析与仪器分析方法比较 化学分析:常量组分C1%),E0.1%~0.2% 准确度高 依据化学反应,使用玻璃仪器 仪器分析:微量组分(<1%),E1%~5% 灵敏度高 依据物理或物理化学性质,需要特殊的仪器 例:含Fe约0.05%的样品,称0.2g,则m(Fe)0.1mg 重量法 m(Fe203)0.14mg,称不准 容量法K2Cr20)≈0.02mL,测不准 光度法结果0.048%0.052%,满足要求 2
2 化学分析:常量组分(>1%), Er 0.1%~0.2% 依据化学反应, 使用玻璃仪器 化学分析与仪器分析方法比较 仪器分析:微量组分(<1%), Er 1%~5% 依据物理或物理化学性质, 需要特殊的仪器 例: 含Fe约0.05%的样品, 称0.2g, 则m(Fe)≈0.1mg 重量法 m(Fe2O3 )≈0.14mg, 称不准 容量法 V(K2Cr2O7 )≈0.02mL, 测不准 光度法 结果0.048%~0.052%, 满足要求 准确度高 灵敏度高

§6.1概述 一、光的基本知识 吸光光度法是基于被测物质的分子对光具 有选择性吸收的特性而建立起来的分析方法。 ·特点 -灵敏度高:测定下限可达10-510-6molL, 104%≈105% 一准确度能够满足微量组分的测定要求: 相对误差2≈5%(1~2%) 一操作简便快速 一应用广泛 3
3 §6.1 概述 • 特点 – 灵敏度高:测定下限可达10-5~10-6mol/L, 10-4%~10-5% – 准确度能够满足微量组分的测定要求: 相对误差2~5% (1~2%) – 操作简便快速 – 应用广泛 一、光的基本知识 吸光光度法是基于被测物质的分子对光具 有选择性吸收的特性而建立起来的分析方法

1.光的基本性质电磁波的波粒二象性 波动性 光的传播速度: v=c=A.v n c一真空中光速2.99792458×108m/s ~3.0×108m/s 一波长,单位:m,cm,mm,m,nm,A 1m=10-6m,1nm=10-9m,1A=10 10m v一频率,单位:赫芝(周)Hz次/秒 n一折射率,真空中为1 4
4 1.光的基本性质 电磁波的波粒二象性 c-真空中光速 2.99792458×108m/s ~3.0 ×108m/s λ-波长,单位:m,cm,mm, m,nm,Å 1 m=10-6m, 1nm=10-9m, 1Å=10- 10m ν-频率,单位:赫芝(周)Hz 次/秒 n-折射率,真空中为1 = = c V n 光的传播速度: 波动性
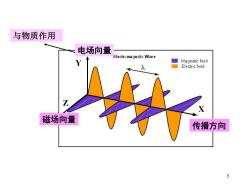
与物质作用 电场向量 Electromagnetic Wav e Y Magnetic field Ele ctric field 磁场向量 传播方向 5
5 磁场向量 电场向量 传播方向 Y Z X 与物质作用

微粒性 光量子,具有能量。 E=h.v h一普朗克(Planck)常数 6.626×10-34Js V一频率 E一光量子具有的能量 单位:J(焦耳),eV(电子伏特) 6
6 微粒性 h-普朗克(Planck)常数 6.626×10-34J·s -频率 E-光量子具有的能量 单位:J(焦耳),eV(电子伏特) 光量子,具有能量。 E h =

波粒二象性 C E=h-=hv 真空中:E=h nλ 结论:一定波长的光具有一定的能量,波长越 长(频率越低),光量子的能量越低。 单色光:具有相同能量(相同波长)的光。 混合光:具有不同能量(不同波长)的光复合在 一起。 7
7 波粒二象性 结论:一定波长的光具有一定的能量,波长越 长(频率越低),光量子的能量越低。 单色光:具有相同能量(相同波长)的光。 混合光:具有不同能量(不同波长)的光复合在 一起。 = = c E h h n 真空中: = c E h

2、光学光谱区 远紫外 近紫外 可见 近红外 中红外 远红外 (真空紫外) 10nm~200nm 200nm 380nm 780nm 2.5 m 50 m -380nm -780nm ≈2.5 ~50 -300 m m m 8
8 2、光学光谱区 远紫外 近紫外 可见 近红外 中红外 远红外 (真空紫外) 10nm~200nm 200nm ~380nm 380nm ~ 780nm 780 nm ~ 2.5 m 2.5 m ~ 50 m 50 m ~300 m
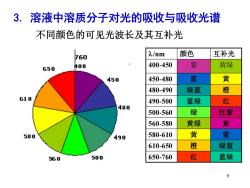
3.溶液中溶质分子对光的吸收与吸收光谱 不同颜色的可见光波长及其互补光 F60 入/nm 颜色 互补光 650 400 400-450 紫 黄绿 450 450-480 蓝 黄 480-490 绿蓝 橙 610 490-500 蓝绿 红 480 500-560 绿 红紫 560-580 黄绿 紫 580 490 580-610 黄 蓝 610-650 橙 绿蓝 560 500 650-760 红 蓝绿
9 3. 溶液中溶质分子对光的吸收与吸收光谱 /nm 颜色 互补光 400-450 紫 黄绿 450-480 蓝 黄 480-490 绿蓝 橙 490-500 蓝绿 红 500-560 绿 红紫 560-580 黄绿 紫 580-610 黄 蓝 610-650 橙 绿蓝 650-760 红 蓝绿 不同颜色的可见光波长及其互补光

4、物质的颜色 物质的颜色由物质对光的吸收、透过、反射情 况来决定。 (1)、固体物质的颜色: 由物质对光的吸收、反射决定。 A.全部吸收:黑色 B:全部反射:白色 C:均等吸收:灰色 D:反射某光,吸收其它光:颜色由反射光决定 如:红旗就是红旗表面反射红光,而吸收其它 光,所以呈红色。 10
10 4、物质的颜色 (1)、固体物质的颜色: 由物质对光的吸收、反射决定。 A. 全部吸收:黑色 B: 全部反射:白色 C:均等吸收:灰色 D:反射某光,吸收其它光:颜色由反射光决定 • 如:红旗就是红旗表面反射红光,而吸收其它 光,所以呈红色。 物质的颜色由物质对光的吸收、透过、反射情 况来决定
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 闽江学院:《分析化学》课程教学资源(PPT课件)第五章 重量分析法.ppt
- 闽江学院:《分析化学》课程教学资源(PPT课件)第四章 氧化还原滴定法.ppt
- 闽江学院:《分析化学》课程教学资源(PPT课件)第三章 络合滴定法.ppt
- 闽江学院:《分析化学》课程教学资源(PPT课件)第一章 定量分析化学概论.ppt
- 闽江学院:《分析化学》课程教学资源(实验讲义)分析化学实验指导.doc
- 闽江学院:《分析化学》课程教学资源(PPT课件)绪论 Analytical Chemistry.ppt
- 河北科技大学:《生物化学》课程教学资源(PPT课件)第十四章 细胞代谢与基因表达调控.ppt
- 河北科技大学:《生物化学》课程教学资源(PPT课件)第十三章 核酸代谢 第二节 DNA的生物合成和修复 第三节 RNA的生物合成和加工.ppt
- 河北科技大学:《生物化学》课程教学资源(PPT课件)第十三章 核酸代谢 第一节 核酸的降解和核苷酸代谢.ppt
- 河北科技大学:《生物化学》课程教学资源(PPT课件)第十二章 蛋白质代谢.ppt
- 河北科技大学:《生物化学》课程教学资源(PPT课件)第十一章 脂代谢.ppt
- 河北科技大学:《生物化学》课程教学资源(PPT课件)第十章 糖代谢.ppt
- 河北科技大学:《生物化学》课程教学资源(PPT课件)第八章 新陈代谢总论.ppt
- 河北科技大学:《生物化学》课程教学资源(PPT课件)第七章 激素.ppt
- 河北科技大学:《生物化学》课程教学资源(PPT课件)第六章 核酸.ppt
- 河北科技大学:《生物化学》课程教学资源(PPT课件)第五章 维生素与辅酶 vitamin.ppt
- 河北科技大学:《生物化学》课程教学资源(PPT课件)第四章 酶学.ppt
- 河北科技大学:《生物化学》课程教学资源(PPT课件)第三章 蛋白质 第五节 蛋白质的分离、纯化和表征.ppt
- 河北科技大学:《生物化学》课程教学资源(PPT课件)第三章 蛋白质 第四节 蛋白质结构与相关功能.ppt
- 河北科技大学:《生物化学》课程教学资源(PPT课件)第三章 蛋白质 第三节 蛋白质的三维结构.ppt
- 闽江学院:《分析化学》课程教学资源(PPT课件)第七章 分析化学中的数据处理.ppt
- 闽江学院:《分析化学》课程教学资源(PPT课件)第八章 分析化学中常见的分离和富集方法.ppt
- 《无机与分析化学》课程教学资源(PPT课件)第十章 条件稳定常数和络合滴定 Conditional stability constant and complexometric titration.ppt
- 《无机与分析化学》课程教学资源(PPT课件)第十一章 条件电势和氧化还原滴定 Conditional electric potential and Oxidation-reduction.ppt
- 《无机与分析化学》课程教学资源(PPT课件)第十二章 S区元素 s-Block Elements.ppt
- 《无机与分析化学》课程教学资源(PPT课件)第十三章 P区元素 p-block elements(一).ppt
- 《无机与分析化学》课程教学资源(PPT课件)第十四章 P区元素 p-block Elements(2).ppt
- 《无机与分析化学》课程教学资源(PPT课件)第十六章 f区元素 f-Block Elements.ppt
- 《无机与分析化学》课程教学资源(PPT课件)第十七章 氢 Hydrogen.ppt
- 《无机与分析化学》课程教学资源(PPT课件)第十八章 核化学简介 Introduction to Nuclear Chemistry.ppt
- 《无机与分析化学》课程教学资源(PPT课件)第一章 原子结构和元素周期表 Atomic Structure and the Periodic Table of Elements.ppt
- 《无机与分析化学》课程教学资源(PPT课件)第二章 化学键与分子结构 Chemical Bond and Molecular Structure.ppt
- 《无机与分析化学》课程教学资源(PPT课件)第三章 化学热力学的初步概念与化学平衡 Primary Conception of Chemical Thermodynamics & Chemical Equilibrium.ppt
- 《无机与分析化学》课程教学资源(PPT课件)第四章 化学反应速率与化学动力学的初步概念 Primary Conception of Chemical Reaction Rate and Chemical Kinetics.ppt
- 《无机与分析化学》课程教学资源(PPT课件)第五章 酸、碱和酸碱反应 Acid, base and acid-base reaction.ppt
- 《无机与分析化学》课程教学资源(PPT课件)第六章 氧化还原反应与电化学 Oxidation-reduction reaction and electrochemistry.ppt
- 《无机与分析化学》课程教学资源(PPT课件)第七章 配位化合物 Coordination Compounds.ppt
- 《无机与分析化学》课程教学资源(PPT课件)第八章 酸碱平衡和酸碱滴定 Acid-base equilibrium and acid-base titration.ppt
- 《无机与分析化学》课程教学资源(PPT课件)第九章 沉淀-溶解平衡和沉淀滴定 Precipitation -dissolution equilibrium and precipitation titration.ppt
- 浙江科技大学(浙江科技学院):《无机及分析化学》课程教学资源(讲义)第十章 p区常见元素及其主要化合物(p BLOCK ELEMENTS AND THEIR MAIN COMPOUNDS).pdf
