北京化工大学:《基础化学》课程教学资源(PPT课件)第11章 主族元素

第11章主族元秦(5h) 11.1 单质 11.2 氢化物 11.3 卤化物 11.4 含氧酸的种类及性质 11.5 简单含氧酸的结构 11.6含氧酸酸性强弱 11.7非金属含氧酸及其盐的性质 本章作业
第11章 主族元素 (5h) 11.1 单质 11.2 氢化物 11.3 卤化物 11.4 含氧酸的种类及性质 11.5 简单含氧酸的结构 11.6 含氧酸酸性强弱 11.7 非金属含氧酸及其盐的性质 本章作业
蜀 18 IA 0 2 13 1415 16 17 1 A IIIA IVA VA VIA VIA He 2 Li e B c 0 F Ne 3 4 5 6 7 N 8 9 101112 3 a Mg IIE IVB VB VIB VIB 四 IB IIB Al Si P CI Ax Ca Se Ti Cx n Fe Co Ni Cu Zn Ga Ge As Se Bx K 5 Rb Sx Y Zx b Mo Te Ru h Pd Ag cd In Sn Sb Te I Xe 6 Cs Ba Lu Ha Ta V Re Os Ir Pt Au Hg TI Pb Bi Po At m Ra Lx Rf 坠 Sg Bh s 匙 铖系 La Ce Px b Pn Sn Eu Gd Tb Dy Ho Er Tm Yb 钢系 Ac Pa P如Cn欧Cf Es En Md

11.1 单质 11.1.1单质概述 11.1.2单质的化学性质 ○11.1.3 氟、氯、溴、碘单质的制备 冈
11.1 单质 11.1.1 单质概述 11.1.2 单质的化学性质 11.1.3 氟、氯、溴、碘单质的制备

11.1单质 11.1.1单质概述 金属单质:原子间以金属键结合 非金属单质:原子间以共价键结合,非金属除H之外都在区。 族非金属的每个原子可以提供8-n个价电子,可以与相邻的 8-个原子形成8-个共价单键,称为8-规则(氢元素2-个)。 稀有气体:8-=0,单原子分子,范氏力形成分子晶体 IA族元素:8-7=1,形成双原子分子,范氏力成分子晶体 IA族:8-6=2,形成多原子分子,如S等 VA族:8-5=3等,形成多原子分子,如P等 只有O2、N2不以单键键合,其它均符合8-规则
金属单质:原子间以金属键结合 n族非金属的每个原子可以提供8-n个价电子,可以与相邻的 8-n个原子形成8-n个共价单键, 称为8-n规则 (氢元素2-n个)。 稀有气体:8-n=0,单原子分子,范氏力形成分子晶体 ⅦA族元素:8-7=1,形成双原子分子,范氏力成分子晶体 ⅥA族:8-6=2,形成多原子分子,如S8等 11.1.1 单质概述 非金属单质:原子间以共价键结合,非金属除H之外都在p区。 s s s s s s s s ⅤA族:8-5=3等,形成多原子分子,如P4等 只有O2、N2不以单键键合,其它均符合8-n规则 P P P P 11.1 单质

11.1单质 e06066000650t0英60060606006t6006600 小分子物质:稀有气体、X2、H2、O2、N2等 非金属单质 多原子分子物质:Sg、P4、As等 巨型分子物质:金刚石、石墨、C60等
非金属单质 小分子物质:稀有气体、X2、H2、O2、N2等 多原子分子物质:S8、P4、As4等 巨型分子物质:金刚石、石墨、C60等 11.1 单质

11.1单质 e63000606600t6达60065066665td056t600达收 11.1.2单质的化学性质 1.单质的氧化还原性 s区元素一单质均为活泼金属,具有很强的还原性易形成阳 离子盐 p区元素一绝大多数非金属元素即具有氧化性,又具有还原性 与金属作用时表现出氧化性,形成负氧化值,如:氧化物、 硫化物、氮化物、碳化物、卤化物、硅化物、硼化物、含氧 酸盐(如:NaBiO3)等 与活泼非金属反应时表现出还原性,形成正氧化值,如:氧化 物、卤化物、氢化物、含氧酸等 ☒
11.1.2 单质的化学性质 1. 单质的氧化还原性 s区元素——单质均为活泼金属,具有很强的还原性易形成阳 离子盐 p区元素——绝大多数非金属元素即具有氧化性,又具有还原性 •与金属作用时表现出氧化性,形成负氧化值,如:氧化物、 硫化物、氮化物、碳化物、卤化物、硅化物、硼化物、含氧 酸盐(如:NaBiO3 )等 •与活泼非金属反应时表现出还原性,形成正氧化值,如:氧化 物、卤化物、氢化物、含氧酸等 11.1 单质
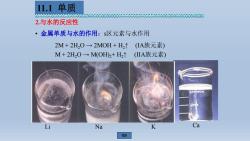
11.1单质 e00606600英0t0英近00000666000660600000006005Q 2.与水的反应性 ·金属单质与水的作用:s区元素与水作用 2M+2HO→2MOH+H2↑ IA族元素) M+2H20→M(OH2+H2↑ (ⅡA族元素) Li Na K Ca
2.与水的反应性 • 金属单质与水的作用:s区元素与水作用 2M + 2H2O → 2MOH + H2↑ (IA族元素) Li Na K Ca M + 2H2O → M(OH)2+ H2↑ (IIA族元素) 11.1 单质

11.1单质 6t55065050600英0050女66免6660t066达英英66 ·卤素与水的作用 F2、Cl2、B2与水的作用 2X2+2H20=4HX+O2↑(氧化水的作用) C2、Br2、I2在水中的歧化反应 X,+H,O=H+X+HXO(可逆反应,碱性严重) 注:除卤素外大部分非金属元素不与水反应
• 卤素与水的作用 F2、Cl2、Br2与水的作用 2X2+2H2O=4HX+O2↑(氧化水的作用) Cl2、Br2、I2在水中的歧化反应 X2+H2O =H++X-+HXO (可逆反应,碱性严重) 注:除卤素外大部分非金属元素不与水反应 11.1 单质

11.1单质 666000066560005600600灰055t066600660060t060560000心00坎 3.与酸的反应性 ·大部分金属元素可以与酸反应,置换出氢气 如:2A1+6HC1=2A1CI3+3H2↑ ·非金属一般不和稀酸反应,L2、S、P、C、B可与浓HNO3或热 的浓HSO4反应,反应方程式如下: S+2HNO3=H,SO4+2NO↑ 3P4+8H2O+20HNO312HP04+20N0↑ 3C+4HNO3=3C02↑+4N0↑+2H20 3I2+10HNO,=6HIO+10NO1+2H2O B+3HNO;=B(OH)3 +3NO21 2B+3H2S0,(热浓)=2B(0H)3+3S021
3. 与酸的反应性 • 大部分金属元素可以与酸反应,置换出氢气 如:2Al+6HCl=2AlCl3+3H2↑ • 非金属一般不和稀酸反应,I2、S、P、C、B可与浓HNO3或热 的浓H2SO4反应,反应方程式如下: S+2HNO3=H2SO4+2NO↑ 3P4+8H2O+20HNO3=12H3PO4+20NO↑ 3C+4HNO3=3CO2↑ +4NO↑ +2H2O 3I2+10HNO3=6HIO3+10NO↑+2H2O B+3HNO3=B(OH)3 +3NO2 ↑ 2B+3H2SO4 (热浓)=2B(OH)3 +3SO2↑ 11.1 单质
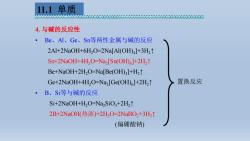
11.1单质 6p63006000000t6达06006500656655t6655560060女 4.与碱的反应性 。 Be、Al、Ge、Sn等两性金属与碱的反应 2Al+2NaOH+6H2O=2Na[Al(OD)4]+3H2t↑ Sn+2NaOH+4H2O=Na,[Sn(OH)]+2H21 Be+NaOH+2H2O=Na[Be(OH)3]+H21 Ge+2NaOH+4H,O=Na,[Ge(OH)]+2H21 置换反应 ·B、Si等与碱的反应 Si+2NaOH+H2O=Na2SiO,+2H21 2B+2NaOH(热浓)+2HO-2NaBO2+3H2↑ (偏硼酸钠)
4. 与碱的反应性 • Be、Al、Ge、Sn等两性金属与碱的反应 2Al+2NaOH+6H2O=2Na[Al(OH)4 ]+3H2↑ Sn+2NaOH+4H2O=Na2 [Sn(OH)6 ]+2H2↑ Be+NaOH+2H2O=Na[Be(OH)3 ]+H2↑ Ge+2NaOH+4H2O=Na2 [Ge(OH)6 ]+2H2↑ • B、Si等与碱的反应 Si+2NaOH+H2O=Na2SiO3+2H2↑ 2B+2NaOH(热浓)+2H2O=2NaBO2+3H2↑ (偏硼酸钠) 置换反应 11.1 单质
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 北京化工大学:《基础化学》课程教学资源(PPT课件)第05章 酸碱平衡(Acid-Base Equilibria).pptx
- 北京化工大学:《基础化学》课程教学资源(PPT课件)第10章 配位化合物和配位平衡.pptx
- 北京化工大学:《基础化学》课程教学资源(PPT课件)第09章 化学键和分子结构.pptx
- 北京化工大学:《基础化学》课程教学资源(PPT课件)第08章 原子结构和元素周期率.pptx
- 北京化工大学:《基础化学》课程教学资源(PPT课件)第07章 氧化还原反应.pptx
- 北京化工大学:《基础化学》课程教学资源(PPT课件)第06章 难溶电解质的沉淀溶解平衡.pptx
- 北京化工大学:《基础化学》课程教学资源(PPT课件)第04章 化学反应速率及化学平衡.pptx
- 北京化工大学:《基础化学》课程教学资源(PPT课件)第03章 化学热力学基础.pptx
- 北京化工大学:《基础化学》课程教学资源(PPT课件)第02章 物质的聚集状态和溶液.pptx
- 北京化工大学:《基础化学》课程教学资源(PPT课件)第01章 绪论 Fundamental Chemistry(负责人:李保山).pptx
- 北京化工大学:《基础化学》课程教学资源(试卷习题)2013-2014学年第一学期《基础化学》期中考试试卷及参考答案.pdf
- 北京化工大学:《基础化学》课程教学资源(试卷习题)2012-2013学年第一学期国际班《基础化学》期中考试试卷及参考答案.pdf
- 《基础化学》课程教学资源(文献资料)Quantum gas goes below absolute zero.doc
- 《基础化学》课程教学资源(文献资料)合成氨进展——科学家开发出氨合成节能技术.pdf
- 《基础化学》课程教学资源(文献资料)碘与指纹破案.pdf
- 《基础化学》课程教学资源(文献资料)诺贝尔化学奖全书(1901-2001)2/2.pdf
- 《基础化学》课程教学资源(文献资料)诺贝尔化学奖全书(1901-2001)1/2.pdf
- 北京化工大学:《基础化学》课程教学资源(PPT讲稿)酸碱总结.ppt
- 北京化工大学:《基础化学》课程教学资源(实验指导)硫酸亚铁铵的制备及产品质量的分析.pdf
- 北京化工大学:《基础化学》课程教学资源(实验指导)硫酸铜的提纯及产品质量和性能的分析.pdf
- 北京化工大学:《基础化学》课程教学资源(PPT课件)第12章 过渡元素.pptx
- 北京化工大学:《化学反应工程》课程教学资源(PPT课件讲稿)化学反应工程(第二版,共九章,负责人:郭锴).ppt
- 北京化工大学:《化学反应工程》课程PPT教学课件(英文版)Chemical reaction engineering(2009)Chapter 01-05.ppt
- 北京化工大学:《化学反应工程》课程PPT教学课件(英文版)Chemical reaction engineering(2010)Chapter 17-18.ppt
- 北京化工大学:《化学反应工程》课程PPT教学课件(英文版)Chemical reaction engineering(2010)Chapter 06-10.ppt
- 北京化工大学:《化学反应工程》课程PPT教学课件(英文版)Chemical reaction engineering(2011)Chapter 11-15.ppt
- 北京化工大学:《有机分析》课程教学资源(实验指导,高职,文字版).pdf
- 河北医科大学:《天然药物化学》课程教学资源(大纲教材)天然药物化学中英文对照专业词汇(2009版).pdf
- 河北医科大学:《天然药物化学》课程教学资源(大纲教材)天然药物化学教学大纲(2014版).pdf
- 河北医科大学:《天然药物化学》课程教学资源(大纲教材)天然药物化学教学大纲(2015版).pdf
- 河北医科大学:《天然药物化学》课程教学资源(大纲教材)本科天然药物化学教学大纲(2017版).pdf
- 河北医科大学:《天然药物化学》课程教学资源(大纲教材)天然药物化学中英文对照专业词汇(2018版).pdf
- 河北医科大学:《天然药物化学》课程教学资源(复习题集)天然药物化学复习题(2014版,无答案).pdf
- 河北医科大学:《天然药物化学》课程教学资源(复习题集)本科学生专业选修课《有机分析》习题(无解答).pdf
- 河北医科大学:《天然药物化学》课程教学资源(复习题集)天然药物化学复习题(海洋天然产物,含答案).pdf
- 《天然药物化学》课程参考文献(海洋天然产物)D.S. Bhakuni&D.S. Rawat《Bioactive marine natural products》.pdf
- 《天然药物化学》课程参考文献(海洋天然产物)Deep-sea natural products.pdf
- 《天然药物化学》课程参考文献(海洋天然产物)Drugs from the Sea - Opportunities and Obstacles.pdf
- 《天然药物化学》课程参考文献(海洋天然产物)Marine-Sourced Anti-Cancer and Cancer Pain Control Agents in Clinical and Late Preclinical Development.pdf
- 《天然药物化学》课程参考文献(海洋天然产物)Highlights of marine natural products chemistry(1972–1999).pdf
