《化学反应工程》课程教学资源(随堂PPT课件)第9章 气固相催化反应过程的传递

Chemical Reaction Engineering 9.气固催化反应过程的传递现象 In 非均相催化反应 活性组分 ????m2g活性炭 催化剂 载体一多孔(内表面>外表面) 改变反应途径。 Out 催化作用 改变达到平衡的时间,不改变平衡状态。 催化剂具有选择性。 AL203 C,H+H,O C2H,OH Zno 一CH,CHO+H ALOZno,1/2CH,=CH-CH=CH2+H2O+1/2H2
Chemical Reaction Engineering 非均相催化反应 催化作用 改变反应途径。 改变达到平衡的时间,不改变平衡状态。 催化剂具有选择性。 催化剂 活性组分 载体—多孔(内表面>>外表面) ??????m2 /g活性炭 In Out 9.气固催化反应过程的传递现象
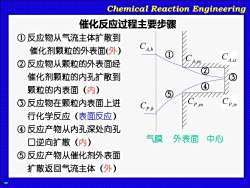
Chemical Reaction Engineering 催化反应过程主要步骤 ①反应物从气流主体扩散到 催化剂颗粒的外表面外) CA.b ②反应物从颗粒的外表面经 催化剂颗粒的内孔扩散到 颗粒的内表面(内) ③反应物在颗粒内表面上进 行化学反应(表面反应) ④反应产物从内孔深处向孔 口逆向扩散(内) 气膜 外表面 中心 ⑤反应产物从催化剂外表面 扩散返回气流主体(外)
Chemical Reaction Engineering ① 反应物从气流主体扩散到 催化剂颗粒的外表面(外) ② 反应物从颗粒的外表面经 催化剂颗粒的内孔扩散到 颗粒的内表面(内) ③ 反应物在颗粒内表面上进 行化学反应(表面反应) ④ 反应产物从内孔深处向孔 口逆向扩散(内) ⑤ 反应产物从催化剂外表面 扩散返回气流主体(外) 催化反应过程主要步骤 CA es , CA b, CA is, 气膜 外表面 中心 ① ② ③ ④ ⑤ CP es , CP is, CP b

Chemical Reaction Engineering 浓度与温度分布 膜 食秦 :的 簸 气相主体 es 放热 Th Tes >Tis
Chemical Reaction Engineering p b p es p i s A b A es A i s C C C C C C , , , , , , 放热 吸热 b es is b es is T T T T T T 浓度与温度分布 Tb Tes Tis es Tb T 气 相 主 体 气 膜 气 膜 气 相 主 体 主 体 气 膜 气 膜 主 体 A A P P

Chemical Reaction Engineering 颗粒尺度 传质尺度 床层尺度 气固催化反应的传递过程存在着两种不同的尺度 (1)微团尺度的传递 颗粒尺度的内外传递过程。 (2)设备尺度的传递 反应器整体而言,由于反应物料流动的不均匀性, 温度的不均匀性等原因,在反应器径向和轴向上同样会 有反应物料的浓度差和温度差,而任何浓度差异和温度 差异都将导致热质传递。 物质传递 反应场所 反应速率 反应结果 热量传递 CT
Chemical Reaction Engineering 传质尺度 颗粒尺度 床层尺度 气固催化反应的传递过程存在着两种不同的尺度 (1) 微团尺度的传递 颗粒尺度的内外传递过程。 (2) 设备尺度的传递 反应器整体而言,由于反应物料流动的不均匀性, 温度的不均匀性等原因,在反应器径向和轴向上同样会 有反应物料的浓度差和温度差,而任何浓度差异和温度 差异都将导致热质传递。 物质传递 反应速率 反应结果 热量传递 反应场所 C T

Chemical Reaction Engineering 9.1研究方法 (r)=f(Tis:Cis) 会 銮 ()-ke cia (1)效率因子法 (-r4)=nf(T6,C6) 可以测:气相主体 浓度CAb温度Tb (-ra)=nkoe 不可测:反应场所 7一反应速率效率因子 浓度CAs、温度Ts
Chemical Reaction Engineering 9.1研究方法 ⑴效率因子法 ( ) ( , ) A Ti s Ci s −r = f 0 , ( ) is E RT n A A is r k e c − − = ( ) ( , ) A Tb Cb −r = f ——反应速率效率因子 可以测:气相主体 浓度CAb、温度Tb 不可测:反应场所 浓度CAis、温度Tis 0 , ( ) b E RT n A A b r k e c − − = 本 征

Chemical Reaction Engineering E (2)表观动力学法 (-ra)=koe 以气相主体的温度、浓度关联动力学方程: R=G(T6,C6) 表观级数 n R=koe 表观活化能 E A.b 床层动力学一包含内、外扩散的动力学 颗粒动力学一包含内扩散的动力学 效率因子法→以本征动力学为基础→判断影响程度 表观动力学法→以实际测定参数关联→设计应用
Chemical Reaction Engineering ( , ) R = G Tb Cb ⑵表观动力学法 以气相主体的温度、浓度关联动力学方程: 表观级数 表观活化能 n E 床层动力学—包含内、外扩散的动力学 颗粒动力学—包含内扩散的动力学 效率因子法 →以本征动力学为基础→判断影响程度 表观动力学法→以实际测定参数关联→设计应用 0 , b E RT n R k e cA b − = 0 , ( ) is E RT n A A is r k e c − − =

Chemical Reaction Engineering 9.2.等温条件下的外部传质过程 气相主体: G 一、反应速率与传递速率 特征:传递→反应(串连过程)一存在控制步骤 反应速率:A→P (-r)=k.Cis=k.Co 传质速率N4=ka(Cb-Ces) 定态下, 传质速率=反应速率 R=N4=(-rA) C ka(C-Ces)=kCl→ es 1+ k a
Chemical Reaction Engineering 9.2. 等温条件下的外部传质过程 反应速率:A→P n es n (−rA ) = k Ci s = k C ( ) A A 定态下, 传质速率=反应速率 R = N = −r 传质速率 ( ) A g a Cb Ces N = k − kg a(Cb −Ces ) = k Ces n ⎯⎯n=1 → k a C k C g b es + = 1 1 一、反应速率与传递速率 特征:传递→反应(串连过程)—存在控制步骤 S 气相主体 G

Chemical Reaction Engineering (①)传质→浓度差异 es b ②传质→CA4es>kga时,Cs≈0外扩散控制 当k<<kga时,Cb≈Ce反应控制
Chemical Reaction Engineering k a C k C g b es + = 1 1 ⑴传质→浓度差异 ⑵传质→ ⑶ →外表面浓度 CA,es CA,b k / kga 当 时, 外扩散控制 当 k kga 时, 反应控制 k kga Ces 0 Cb Ces

Chemical Reaction Engineering 二、 极限反应速率和极限传质速率 实际反应速率R=kC Cp>Ces 传质速率 N=kga(Co-Ces) ()当k<kga时,Cb≈Ce反应控制 R≈kC%=(-ra)lim 极限反应速率(本征) 表观动力学参数 n=n E-E
Chemical Reaction Engineering 二、极限反应速率和极限传质速率 Cb Ces n es 实际反应速率 R = kC( ) g a Cb Ces 传质速率 N = k − lim ( ) A n b R k C = −r 极限反应速率(本征) n n E E = = 表观动力学参数 ⑴当 k kga 时, Cb Ces 反应控制

Chemical Reaction Engineering ②)当k>kga时,Cs≈0外扩散控制 R≈keaC6=(N4)him 表观动力学参数: n=1 D k=kga= D—扩散系数 δ—气膜厚度 D=Doe ED一扩散活化能 E=Ep ED数量级:4一12kJ/mol (1-3 kcal/mol) (本征活化能:40~200kJ/mol)
Chemical Reaction Engineering lim ( ) g aCb NA R k = a D k kg a = = ' RT E D D D e − = 0 表观动力学参数: n =1 D—扩散系数 δ—气膜厚度 ED—扩散活化能 ⑵ 当 k kga 时, Ces 0 外扩散控制 ED数量级:4—12 kJ/mol ( 1-3 kcal/mol ) (本征活化能:40~200 kJ/mol) E E = D
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《化学反应工程》课程教学资源(随堂PPT课件)第10章 热量传递与热稳定性.ppt
- 《化学反应工程》课程教学资源(随堂PPT课件)第11章 化学反应过程开发方法.ppt
- 化学工业出版社:《化学反应工程》课程教材书籍PDF电子版(第四版,主编:朱炳辰,共十二章).pdf
- 《化学反应工程》课程教学资源(作业习题)陈甘棠第三版各章课后答案.pdf
- 《化学反应工程》课程教学资源(作业习题)试题及答案.pdf
- 《化学反应工程》课程教学资源(课件讲稿)第1章 绪论 Chemical Reaction Engineering.pdf
- 《化学反应工程》课程教学资源(课件讲稿)第2章 均相反应动力学(图片版).pdf
- 《化学反应工程》课程教学资源(课件讲稿)第3章 理想间歇反应器(图片版).pdf
- 《化工安全与环保》课程教学资源(课件讲稿)第7章 化学品泄漏与扩散模型.pdf
- 《化工安全与环保》课程教学资源(课件讲稿)第9章 压力容器的设计与使用安全.pdf
- 《化工安全与环保》课程教学资源(课件讲稿)第1章 化工安全工程概论绪论(山东理工大学:付强).pdf
- 《化工安全与环保》课程教学资源(课件讲稿)第2章 国际化学品安全管理体系.pdf
- 《化工安全与环保》课程教学资源(课件讲稿)第3章 中国化学品安全管理体系.pdf
- 《化工安全与环保》课程教学资源(课件讲稿)第4章 化学品的性质特征及其危险性.pdf
- 《化工安全与环保》课程教学资源(课件讲稿)第5章 燃烧和爆炸与防火防爆安全技术.pdf
- 《化工安全与环保》课程教学资源(课件讲稿)第6章 职业毒害与防毒措施.pdf
- 《化工安全与环保》课程教学资源(课件讲稿)第8章 化工厂设计和装置安全.pdf
- 《化工安全与环保》课程教学资源(课件讲稿)第10章 化工厂安全操作与维护.pdf
- 《化工安全与环保》课程教学资源(课件讲稿)第11章 化工环境保护技术.pdf
- 《化学反应工程》课程教学资源(PPT课件)第1章 应用化学反应动力学.ppt
- 《化学反应工程》课程教学资源(随堂PPT课件)第8章 气固相催化反应动力学.ppt
- 《化学反应工程》课程教学资源(随堂PPT课件)第7章 反应器选型与操作优化.ppt
- 《化学反应工程》课程教学资源(随堂PPT课件)第6章 反应器中的混合与非理想流动.ppt
- 《化学反应工程》课程教学资源(随堂PPT课件)第5章 连续流动釜式反应器.ppt
- 《化学反应工程》课程教学资源(随堂PPT课件)第4章 流动管式反应器.ppt
- 《化学反应工程》课程教学资源(随堂PPT课件)第3章 理想间歇反应器.ppt
- 《化学反应工程》课程教学资源(随堂PPT课件)第2章 均相反应动力学.ppt
- 《化学反应工程》课程教学资源(随堂PPT课件)第1章 绪论.ppt
- 《化学反应工程》课程教学资源(课件讲稿)第9章 气固相催化反应过程的传递.pdf
- 《化学反应工程》课程教学资源(课件讲稿)第8章 气固相催化反应动力学.pdf
- 《化学反应工程》课程教学资源(课件讲稿)第7章 反应器选型与操作优化.pdf
- 《化学反应工程》课程教学资源(课件讲稿)第6章 反应器中的混合与非理想流动.pdf
- 《化学反应工程》课程教学资源(课件讲稿)第5章 连续流动釜式反应器(Continuous Stirred Tank Reactor,CSTR).pdf
- 《化学反应工程》课程教学资源(课件讲稿)第4章 流动管式反应器(Ideal Tubular Reactor).pdf
- 《化学反应工程》课程教学资源(课件讲稿)第3章 理想间歇反应器.pdf
- 《化学反应工程》课程教学资源(课件讲稿)第2章 均相反应动力学 Homogeneous Reaction Kinetics.pdf
- 《化学反应工程》课程教学资源(课件讲稿)第4章 反应器中的混合及对反应的影响.pdf
- 《化学反应工程》课程教学资源(作业习题)第2章 习题.pdf
- 《化学反应工程》课程教学资源(作业习题)第1章 练习题.pdf
- 《化学反应工程》课程教学资源(课件讲稿)第0章 绪论 Chemical Reaction Engineering.pdf
