《植物生物学》课程教学资源(文献资料)建兰蜜腺的显微结构及释香研究

热带作物学报2018,39(6):1108-1113Chinese Journal of Tropical Crops建兰蜜腺的显微结构及释香研究侯佳!,王占义2,刘金泉!,范燕萍3*1内蒙古农业大学职业技术学院,内蒙古包头0141092内蒙古农业大学,内蒙古呼和浩特0100203华南农业大学园艺学院,广东广州510642摘要为了解建兰蜜腺在传粉系统中的具体作用,采用固相微萃取和GC/MS技术收集和鉴定了建兰“小桃红”蜜腺的挥发性香气成分,结果显示其只释放17.10ng/(h·g)的邻苯二甲酸二异丁酯。利用光学显微镜、扫描电镜及透射电镜对建兰“小桃红”蜜腺的结构进行了观察,结果表明:(1)建兰蜜腺位于花托基部,由表皮和10多层泌蜜组织细胞构成,薄壁组织中的空泡内有团状贮藏物;(2)蜜腺表面均匀地分布着大量的气孔;(3)蜜腺表皮均匀分布有表皮毛,蜜汁由其项端渗出;(4)蜜腺细胞内细胞器退化明显,细胞内大量灰色物质通过共质体途径向表皮移动。关键词蜜腺:香:泌蜜:建兰中图分类号S682.31文献标识码AMicrostructure and Aroma of Nectary inCymbidium ensifolium (L.) Sw.HOU Jia', WANG Zhanyi, LIU Jinquan', FAN Yanping**1 Vocationdl and Technical College, Inner Mongolia Agricultrual Unirersity, Baotou, Inner Mongolia O14109, China2 Inner Mongolia Agricultrual Uninersity, Huhhot, Inner Mongolia 010020, China3 College of Horticulture, South China Agricultural Unirersity, Guangzhou, Guangdong 510642, ChinaAbstract In order to understand the specific role of the nectary in the pollination system, the volatile aroma componentsof the nectaries were collected and identified by solid-phase microextraction and GC/MS. Only 17.10 ng/(h-g FW)diisobutyl phthalate. The results showed that: () The gland was located in the base of the receptacle, which wascomposed of epidermis and more than 10 layers of honey cells.There were group of ponds in theparenchyma. (2The nectary surface was evenly distributed a large number of stomatas; (3) Nectary skin was evenly distributedepidermal hair, nectary from its top oozing: (4) Nectary cells within the organelles degeneration was obvious, alarge number of cells within the gray matter through the coplanar approach to the epidermis.Keywordsneetar, scent; secretion honey:Cymbidium ensifolium (L.) Swdoi10.3969/j.issn.1000-2561.2018.06.011蜜腺是以兰科植物为代表的被子植物吸引传粉引,形成带有欺骗性的独特花部结构来达到吸引昆昆虫访花的手段-2,其在植物繁殖与农业生产中虫传粉的目的7-9,但大多数兰科植物依靠花蜜或特殊的气味来吸引传粉者,这类兰花大多蜜腺发达均发挥着重要的作用。植物蜜腺一般呈绿色,2~8或香气浓郁[10-12]。对于兰花传粉系统的研究,多集枚不等,呈环状或成对出现:不同物种中蜜腺的表现形式、形态可能完全不同,常见的有乳头状、中在兰花花部独特的欺骗性结构及其对传粉者传环状、粒状等[2,4-5。因蜜腺所在位置不同,将其分粉行为的适应性上,而对为传粉者提供蜜源的蜜为花蜜腺和花外蜜腺围。腺研究较少。对兰属植物花部的研究主要集中在兰亚属和大花亚属的部分种类7,13-14,但迄今为止针兰科(Orchidaceae)是被子植物中最进化的类群之一,全世界约有800个属20000个种,因其多对建兰亚属植物的研究报道甚少间。建兰具有独特、精巧、多样化、与传粉者高度协同进化[Cymbidiumensifolium(L.)Sw.]蜜腺的位置、蜜腺的的花部结构而备受学界关注间。一些兰科植物常常类型、兰膏的出处等也未见明确报道。利用现有植物与传粉者之间的关系、昆虫的性吸建兰“小桃红”盛花期于花梗处见水滴状花收稿日期2017-02-07修回日期2017-07-27基金项目国家自然科学基金资助项目(No.30972026);国家自然科学基金资助项目(No.31560141):教育部高等学校博士学科点专项科研基金(No.20131515120003)。作者简介侯佳(1981一),女,硕士,副教授;研究方向:园林花卉裁培及抗性生理。*通讯作者(Correspondingauthor):范燕萍(FANYanping),E-mail;fanyanping@scau.edu.cno?1994-2019 China Academic Journal Electronic Publishing House.All rights reserved,http://www.cnki.net
蜜腺是以兰科植物为代表的被子植物吸引传粉 昆虫访花的手段[1-2], 其在植物繁殖与农 业生产中 均发挥着重要的作用。 植物蜜腺一般呈绿色, 2~8 枚不等, 呈环状或成对出现[3]; 不同物种中蜜腺的 表现形式、 形态可能完全不同, 常见的有乳头状、 环状、 粒状等[2,4-5]。 因蜜腺所在位置不同, 将其分 为花蜜腺和花外蜜腺[4]。 兰科(Orchidaceae)是被子植物中最进化的类群 之一, 全世界约有 800 个属 20 000 个种, 因其多 具有独特、 精巧、 多样化、 与传粉者高度协同进化 的花部结构而备受学界关注[6]。 一些兰科植物常常 利用现有植物与传粉者之间的关 系、 昆虫的性 吸 引, 形成带有欺骗性的独特花部结构来达到吸引昆 虫传粉的目的[7-9], 但大多数兰科植物依 靠花蜜或 特殊的气味来吸引传粉者, 这类兰花大多蜜腺发达 或香气浓郁[10-12]。 对于兰花传粉系统的研究, 多集 中在兰花花部独特的欺 骗性结构及 其对传粉 者传 粉行为的适应性上, 而对为传粉 者提供蜜源 的蜜 腺研究较少。 对兰属植物花部的研究主要集中在兰 亚属和大花亚属的部分 种类[7,13-14], 但迄今 为止针 对 建 兰 亚 属 植 物 的 研 究 报 道 甚 少 [6]。 建 兰 [Cymbidium ensifolium(L.)Sw.]蜜腺的位置、 蜜腺的 类型、 兰膏的出处等也未见明确报道。 建兰 “小桃红” 盛花期于花 梗处见水 滴 状 花 热带作物学报 2018, 39(6): 1108-1113 Chinese Journal of Tropical Crops 收稿日期 2017-02-07 修回日期 2017-07-27 基金项目 国家自然科学基金资助项目(No. 30972026); 国家自然科学基金资助项目(No. 31560141); 教育部高等学校博士学科点专项科研 基金(No. 20131515120003)。 作者简介 侯 佳(1981—), 女, 硕士, 副教授; 研究方向: 园林花卉栽培及抗性生理。 *通讯作者(Corresponding author): 范燕萍(FAN Yanping), E-mail: fanyanping@scau.edu.cn。 建兰蜜腺的显微结构及释香研究 侯 佳 1 , 王占义 2 , 刘金泉 1 , 范燕萍 3 * 1 内蒙古农业大学职业技术学院, 内蒙古包头 014109 2 内蒙古农业大学, 内蒙古呼和浩特 010020 3 华南农业大学园艺学院, 广东广州 510642 摘 要 为了解建兰蜜腺 在 传 粉系 统 中 的具 体 作 用, 采 用 固 相微 萃 取 和 GC/MS 技 术 收 集和 鉴 定 了建 兰 “小 桃 红” 蜜腺的挥发性香气成分, 结果显示其只释 放 17.10 ng/(h·g)的邻 苯 二 甲酸 二 异 丁酯。 利 用 光学 显 微 镜、 扫 描电镜及透射电镜对建兰 “小桃红” 蜜腺的结构进行了观察, 结果表明: (1)建兰蜜腺位于花托基部, 由表皮和 10 多层泌蜜组织细胞构成, 薄壁组织中的空泡内有团状贮藏物; (2)蜜腺表面均匀地分布着大量的气孔; (3)蜜 腺表皮均匀分布有表皮毛, 蜜汁由其顶端渗出; (4)蜜腺细胞内细胞器退化明显, 细胞内大量灰色物质通过共质 体途径向表皮移动。 关键词 蜜腺; 香; 泌蜜; 建兰 中图分类号 S682.31 文献标识码 A Microstructure and Aroma of Nectary in Cymbidium ensifolium (L.) Sw. HOU Jia1 , WANG Zhanyi2 , LIU Jinquan1 , FAN Yanping3 * 1 Vocational and Technical College, Inner Mongolia Agricultrual University, Baotou, Inner Mongolia 014109, China 2 Inner Mongolia Agricultrual University, Huhhot, Inner Mongolia 010020, China 3 College of Horticulture, South China Agricultural University, Guangzhou, Guangdong 510642, China Abstract In order to understand the specific role of the nectary in the pollination system, the volatile aroma components of the nectaries were collected and identified by solid-phase microextraction and GC/MS. Only 17.10 ng/(h·g FW) diisobutyl phthalate. The results showed that: (1) The gland was located in the base of the receptacle, which was composed of epidermis and more than 10 layers of honey cells. There were group of ponds in the parenchyma. (2) The nectary surface was evenly distributed a large number of stomatas; (3) Nectary skin was evenly distributed epidermal hair, nectary from its top oozing; (4) Nectary cells within the organelles degeneration was obvious, a large number of cells within the gray matter through the coplanar approach to the epidermis. Key words nectar; scent; secretion honey; Cymbidium ensifolium (L.) Sw. doi 10.3969/j.issn.1000-2561.2018.06.011

第39卷-1109-热带作物学报蜜,被兰花爱好者称为兰膏。国兰蜜腺在国兰研究所在花部活体采样,立即投入FAA中固定,经苏中一直处于附属位置,未引起重视。关于建兰蜜腺木精整染、蒸馏水复水、梯度乙醇脱水(每个梯度的报道多基于经验,无实验数据支持。本研究应用停留15s)、二甲苯透明、石蜡包埋及美国A0切片机切片,切片厚度为7~9μm,用中性树胶封片,石蜡切片法和扫描电镜技术研究了建兰小桃红的花蜜腺的位置、形态结构、泌蜜方式等、澄清了兰膏于光学显微镜(OlympusBX51)下观察并照相。的出处。半薄切片法:将建兰蜜腺所在花部活体采样,固定于2.5%戊二醛(用0.1mol/L磷酸缓冲液配制,pH7.2)中,低温(4℃)固定6h;以0.1mol/L磷酸缓1材料与方法冲液冲洗,用1%钱酸室温固定1.5h;用0.1mol/L1.1材料磷酸缓冲液冲洗,经乙醇系列50%、70%、85%选取开放盛期的建兰小桃红花部(样品采自广90%、95%、100%脱水,每级30min:用100%乙州市兰花中心),制作徒手切片,在解镜下确定醇脱水2次,环氧丙烷置换3次,每次20min,用蜜腺的位置后立即取样固定。Spurr树脂浸透并包埋:用LeicaR超薄切片机切1.2方法片,半薄切片厚度为1μm,用甲苯胺蓝染色,于1.2.1气相色谱检测取建兰蜜腺1.0g,置于4mL光学显微镜(OlympusBX51)下观察并照相。螺口玻璃瓶中,加入5μL的31.6ng/μL的癸酸乙1.2.4透射电镜观察光学显微镜观察得到半薄酯作为内标物,用聚四氟乙烯衬里的硅橡胶垫密切片的同时,进行超薄切片,切片厚度70nm:用封;将100μm聚二甲基氧烷(PMDS)萃取纤维头柠檬酸铅-醋酸双氧铀染色后,于PhilipsFEI-插入螺口玻璃瓶中,于25℃下顶空萃取30minTECNAI12透射电镜下观察并照相,加速电压为后,用FinnigaTraceMS气质联用仪(美国日电公司)100kV。分析其香味组分。气相色谱条件。色谱柱用DB-5石英毛细管柱2结果与分析(30mx0.25mm):载气为高纯氢气,分流比20:1,2.1蜜腺释香成分与释放量柱前压50Pa,流量15mL/min:取样时间2min:程建兰蜜腺挥发性成分的总离子流图见图1。序升温:柱起始温度40℃,保持2min,以10℃/min各组分质谱图经计算机谱库(WILEY/MAINLIB)检的速度升至250℃,保持5min。索及资料分析得出,蜜腺中只检测到一种酯类物质质谱条件。GC/MS的接口温度250℃,电子轰邻苯二甲酸二异丁酯(分子式Ci6Hz204),含量为击源El;离子源温度170℃电子能量70eV:扫描17.10 ng/(h·g)。质量范围29~410aum;扫描时间0.3s,间隔0.2s。2.2蜜腺的解剖结构采集到的质谱图用WILEY/MAINLIB库进行分建兰花茎由假鳞茎基部生出,具节和节间,花析,按各峰的质谱图与有关资料进行核对,以确定茎基部具鞘。总状花序具3~9朵花,花梗基部着建兰花器官不同部位的挥发性物质化学成分:采用生花苞片。子房下位,子房与花柄相连,位于花托内标法进行定量分析。按下列公式计算香味各组分内部;子房一室,有3个侧膜胎座,每一胎座生长的含量[ng/(h·g)]:着胚珠,受精后发育成种子。建兰蜜腺位于花托内香味各组分的含量子房,3个心皮不完全愈合处的腔隙周围的表面_各组分的峰面积×内标质量x2三内标的峰面积(图2),心皮不完全愈合形成裂缝,将蜜腺所在花托分成6个部分,3个偏大,3个偏小。蜜汁顺花1.2.2扫描电镜观察取建兰蜜腺所在花部,固梗流至花柄基部。建兰花梗裂生,表皮向内凹陷处定于2.5%戊二醛(用0.1mol/L磷酸缓冲液配制,是不发达的蜜腺种类。建兰蜜腺发育不完全,位于pH7.2)中,低温(4℃)固定4h;以0.1mol/L磷酸缓冲液(PBS)冲洗,用1%钱酸室温固定1h;以花梗上部与花托结合处、蜜腺由表皮和10多层泌蜜组织组成(图3-A),产蜜组织内无维管束;蜜腺0.1mol/L磷酸缓冲液冲洗,经梯度乙醇脱水、乙酸表皮细胞长方形或方形,排列致密,表皮均匀覆盖正戊脂过渡、JFD-310冷冻干燥机干燥:用JFC-一层角质层,经甲苯胺蓝染色呈蓝色(图3-B)。分1600离子溅射仪喷镀1min,在FEI-XL30扫描电泌表皮经苏木精染色后颜色变深,细胞呈切向延长子显微镜下观察并照相。的扁平状细胞,排列紧密;泌蜜组织细胞排列较紧1.2.3光学显微观察石蜡切片法:将建兰蜜腺?1994-2019ChinaAcademic JournalElectronicPublishingHouse.Allrights reserved.http://www.cnki.net
热 带 作 物 学 报 第 39 卷 蜜, 被兰花爱好者称为兰膏。 国兰蜜腺在国兰研究 中一直处于附属位置, 未引起重视。 关于建兰蜜腺 的报道多基于经验, 无实验数据支持。 本研究应用 石蜡切片法和扫描电镜技术研究了建兰小桃红的花 蜜腺的位置、 形态结构、 泌蜜方式等, 澄清了兰膏 的出处。 1 材料与方法 1.1 材料 选取开放盛期的建兰小桃红花部(样品采自广 州市兰花中心), 制作徒手切片, 在解剖镜下确定 蜜腺的位置后立即取样固定。 1.2 方法 1.2.1 气相色谱检测 取建兰蜜腺 1.0 g, 置于 4 mL 螺口玻璃瓶中, 加入 5 μL 的 31.6 ng/μL 的癸酸乙 酯作为内标物, 用聚四氟乙烯 衬里的硅 橡胶垫密 封; 将 100 μm 聚二甲基 氧烷(PMDS)萃取纤 维 头 插 入 螺 口 玻 璃 瓶 中 , 于 25 ℃下 顶 空 萃 取 30 min 后, 用 FinnigaTrace MS 气质联用仪(美国日电公司) 分析其香味组分。 气相色谱条件。 色谱柱用 DB-5 石英毛细管柱 (30 m×0.25 mm); 载气为高纯氦气, 分流比 20 ∶ 1, 柱前压 50 Pa, 流量 15 mL/min; 取样时间 2 min; 程 序升温: 柱起始温度 40 ℃, 保持 2 min, 以 10 ℃/min 的速度升至 250 ℃, 保持 5 min。 质谱条件。 GC/MS 的接口温度 250 ℃, 电子轰 击源 EI; 离子源温度 170 ℃; 电子能量 70 eV; 扫描 质量范围 29~410 aum; 扫描时间 0.3 s, 间隔 0.2 s。 采集到的质谱图用 WILEY/MAINLIB 库进行分 析, 按各峰的质谱图与有关资料进行核对, 以确定 建兰花器官不同部位的挥发性物质化学成分; 采用 内标法进行定量分析。 按下列公式计算香味各组分 的含量[ng/(h·g)]: 香味各组分的含量 = 各组分的峰面积 内标的峰面积 ×内标质量×2 1.2.2 扫描电镜观察 取建兰蜜腺所在花部, 固 定 于 2.5%戊 二 醛(用 0.1 mol/L 磷 酸 缓 冲 液 配 制 , pH7.2)中, 低温(4 ℃)固定 4 h; 以 0.1 mol/L 磷酸 缓 冲 液(PBS)冲 洗, 用 1%锇 酸 室 温 固 定 1 h; 以 0.1 mol/L 磷酸缓冲液冲洗, 经梯度乙醇脱水、 乙酸 正戊脂过渡、 JFD-310 冷冻干燥机干燥; 用 JFC- 1600 离子溅射仪喷镀 1 min, 在 FEI-XL30 扫描电 子显微镜下观察并照相。 1.2.3 光学显微观察 石蜡切片法: 将建兰蜜腺 所在花部活体采样, 立即投入 FAA 中固定, 经苏 木精整染、 蒸馏水复水、 梯度乙醇脱水(每个梯度 停留 15 s)、 二甲苯透明、 石蜡包埋及美国 AO 切 片机切片, 切片厚度为 7~9 μm, 用中性树胶封片, 于光学显微镜(OlympusBX51)下观察并照相。 半薄切片法: 将建兰蜜腺所在花部活体采样, 固定于 2.5%戊二醛(用 0.1 mol/L 磷酸缓冲液配制, pH7.2)中, 低温(4 ℃)固定 6 h; 以 0.1 mol/L 磷酸缓 冲液冲洗, 用 1%锇酸室温固定 1.5 h; 用 0.1 mol/L 磷酸缓冲液冲洗, 经乙醇系列 50%、 70%、 85%、 90%、 95%、 100%脱水, 每级 30 min; 用 100%乙 醇脱水 2 次, 环氧丙烷置换 3 次, 每次 20 min, 用 Spurr 树 脂 浸 透 并 包 埋; 用 LeicaR 超 薄 切 片 机 切 片, 半薄切片厚度为 1 μm, 用甲苯胺蓝染色, 于 光学显微镜(OlympusBX51)下观察并照相。 1.2.4 透射电镜观察 光学显微镜观察得到半薄 切片的同时, 进行超薄切片, 切片厚度 70 nm; 用 柠 檬 酸 铅-醋 酸 双 氧 铀 染 色 后 , 于 Philips FEI - TECNAI12 透 射 电 镜 下 观 察 并 照 相, 加 速 电 压 为 100 kV。 2 结果与分析 2.1 蜜腺释香成分与释放量 建 兰 蜜 腺 挥 发 性 成 分 的 总 离 子 流 图 见 图 1。 各组分 质谱图经 计 算 机 谱 库(WILEY/MAINLIB)检 索及资料分析得出, 蜜腺中只检测到一种酯类物质 邻苯二甲酸 二异丁 酯 (分 子 式 C16H22O4), 含 量 为 17.10 ng/(h·g)。 2.2 蜜腺的解剖结构 建兰花茎由假鳞茎基部生出, 具节和节间, 花 茎基部具鞘。 总状花序具 3~9 朵花, 花梗基部 着 生花苞片。 子房下位, 子房与花柄相连, 位于花托 内部; 子房一室, 有 3 个侧膜胎座, 每一胎座生长 着胚珠, 受精后发育成种子。 建兰蜜腺位于花托内 子房, 3 个 心 皮 不 完 全 愈 合 处 的 腔 隙 周 围 的 表 面 (图 2), 心皮不完全愈合形成裂缝, 将蜜腺所在花 托分成 6 个部分, 3 个偏大, 3 个偏小。 蜜汁顺花 梗流至花柄基部。 建兰花梗裂生, 表皮向内凹陷处 是不发达的蜜腺种类。 建兰蜜腺发育不完全, 位于 花梗上部与花托结合处, 蜜腺由表皮和 10 多层泌 蜜组织组成(图 3-A), 产蜜组织内无维管束; 蜜腺 表皮细胞长方形或方形, 排列致密, 表皮均匀覆盖 一层角质层, 经甲苯胺蓝染色呈蓝色(图 3-B)。 分 泌表皮经苏木精染色后颜色变深, 细胞呈切向延长 的扁平状细胞, 排列紧密; 泌蜜组织细胞排列较紧 1109- -
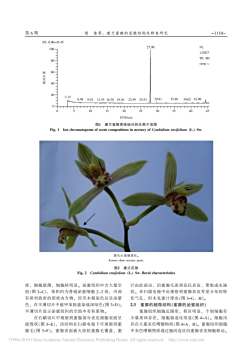
第6期侯佳等:建兰蜜腺的显微结构及释香研究-1110-RT:0.00-45.4527.90NL10071.92E7TTTTIC MS80-samp xTTT60度丰区相40-TTT20~3.1229.8135.486.9822.5925.5339.0242.099.9213.5516.3819.36-0510152025303540450时间/min图1建兰蜜腺香味组分的总离子流图Fig.1lon chromatogram of scent compositions in nectary of Cymbidium ensifolium (L.)Sw.箭头示蜜腺部位。Arrows show nectary parts图2建兰花部Fig.2 Cymbidium ensifolium (L.)Sw.floral characteristies密,细胞壁薄,细胞核明显。泌蜜组织中含大量空汁由此泌出,沿蜜腺毛流到花托表皮,聚集成水滴状。在扫描电镜中还观察到蜜腺表皮零星分布的特泡(图3-C),体积约为普通泌蜜细胞2~3倍,内部有排列致密的团状内含物,经苏木精染色后呈深紫化气孔,但未见蜜汁排出(图3-G、H)。色,在半薄切片中被甲苯胺蓝染成深绿色(图3-D);2.3蜜腺的超微结构(蜜腺的泌蜜组织)半薄切片显示泌蜜组织的空泡中有积累物。蜜腺组织细胞近圆形,核区明显,个别细胞有在石蜡切片中观察到蜜腺部分表皮细胞表面呈少量质体存在,细胞器退化明显(图4-A)。细胞内破毁状(图3-E),该结构在扫描电镜下可观察到蜜存在大量灰色嗜物质(图4-A、B)。蜜腺组织细胞腺毛(图3-F):蜜腺表面被火炬状蜜腺毛覆盖,蜜中灰色嗜钱物质通过胞间连丝向蜜腺表皮细胞移动。?1994-2019China Academic Journal Electronic Publishing House.All rights reserved.http://www.enki.net
第 6 期 密, 细胞壁薄, 细胞核明显。 泌蜜组织中含大量空 泡(图 3-C), 体积约为普通泌蜜细胞 2~3 倍, 内部 有排列致密的团状内含物, 经苏木精染色后呈深紫 色, 在半薄切片中被甲苯胺蓝染成深绿色(图 3-D); 半薄切片显示泌蜜组织的空泡中有积累物。 在石蜡切片中观察到蜜腺部分表皮细胞表面呈 破毁状(图 3-E), 该结构在扫描电镜下可观察到蜜 腺毛(图 3-F); 蜜腺表面被火炬状蜜腺毛覆盖, 蜜 汁由此泌出, 沿蜜腺毛流到花托表皮, 聚集成水滴 状。 在扫描电镜中还观察到蜜腺表皮零星分布的特 化气孔, 但未见蜜汁排出(图 3-G、 H)。 2.3 蜜腺的超微结构(蜜腺的泌蜜组织) 蜜腺组织细胞近圆形, 核区明显, 个别细胞有 少量质体存在, 细胞器退化明显(图 4-A)。 细胞内 存在大量灰色嗜锇物质(图 4-A、 B)。 蜜腺组织细胞 中灰色嗜锇物质通过胞间连丝向蜜腺表皮细胞移动。 箭头示蜜腺部位。 Arrows show nectary parts. 图2 建兰花部 Fig. 2 Cymbidium ensifolium (L.) Sw. floral characteristics 侯 佳等: 建兰蜜腺的显微结构及释香研究 图1 建兰蜜腺香味组分的总离子流图 Fig. 1 Ion chromatogram of scent compositions in nectary of Cymbidium ensifolium (L.) Sw. 时间/min 100 80 60 40 20 0 0 5 10 15 20 25 30 35 40 45 相 对 丰 度 RT: 0.00-45.45 NL 1.92E7 TIC MS samp x 3.12 6.98 9.92 13.55 16.38 19.36 22.59 25.53 27.90 29.81 35.48 39.02 42.09 1110- -
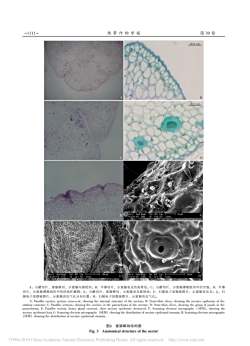
热带作物学报第39卷-1111-50.0mA:石蜡切片,蜜腺横切,示蜜腺内部组织:B:半薄切片,示蜜腺表皮的角质层:C:石蜡切片,示蜜腺薄壁组织中的空泡:D:半薄切片,示蜜腺薄壁组织中的团状贮藏物;E:石蜡切片,蜜腺横切,示蜜腺表皮破毁处:F:扫描电子显微镜照片,示蜜腺表皮毛:G:扫描电子显微镜照片,示蜜腺表皮气孔分布位置:H:扫描电子显微镜照片,示蜜腺表皮气孔。A: Paraffin seetion, nectary crosscut, showing the internal structure of the nectary; B: Semithin slices, showing the nectary epidermis of thestratum corneum; C: Paraffin sections, showing the cavities in the parenchyma of the nectary: D: Semi-thin slices, showing the group of ponds in theparenchyma: E: Parafin section, honey gland crosscut, show nectary epidermis destroyed: F: Scanning celectron micrographs (SEM), showing thenectary epidermis hair, G: Scanning clectron micrographs (SEM) showing the distribution of nectary epidermal stomata, H: Scanning elcctron micrographs(SEM)showingthedistributionof nectaryepidermal stomata.图3蜜腺解剖结构图Fig.3Anatomical structure of the nectar?1994-2019ChinaAcademic Journal ElectronicPublishingHouse.Allrights reserved.http://www.enki.net
热 带 作 物 学 报 第 39 卷 A: 石蜡切片, 蜜腺横切, 示蜜腺内部组织; B: 半薄切片, 示蜜腺表皮的角质层; C: 石蜡切片, 示蜜腺薄壁组织中的空泡; D: 半薄 切片, 示蜜腺薄壁组织中的团状贮藏物; E: 石蜡切片, 蜜腺横切, 示蜜腺表皮破毁处; F: 扫描电子显微镜照片, 示蜜腺表皮毛; G: 扫 描电子显微镜照片, 示蜜腺表皮气孔分布位置; H: 扫描电子显微镜照片, 示蜜腺表皮气孔。 A: Paraffin section, nectary cross-cut, showing the internal structure of the nectary; B: Semi-thin slices, showing the nectary epidermis of the stratum corneum; C: Paraffin sections, showing the cavities in the parenchyma of the nectary; D: Semi-thin slices, showing the group of ponds in the parenchyma; E: Paraffin section, honey gland crosscut, show nectary epidermis destroyed; F: Scanning electron micrographs ( SEM), showing the nectary epidermis hair; G: Scanning electron micrographs (SEM) showing the distribution of nectary epidermal stomata; H: Scanning electron micrographs (SEM) showing the distribution of nectary epidermal stomata. 图3 蜜腺解剖结构图 Fig. 3 Anatomical structure of the nectar A B C D E F G H 1111- -
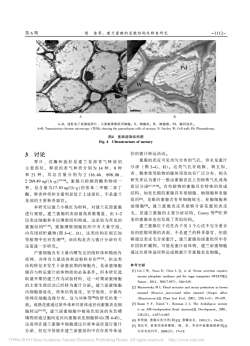
第6期侯佳等:建兰宝腺的显微结构及释香研究-1112-NNPdWBNBAA~B:透射电子微镜照片,示蜜腺薄壁组织细胞;N:细胞核;W:细胞壁;Pd:胞间连丝。AB: Transmission electron microscopy (TEM), showing the parenchyma cells of nectary; N: Nucles; W: Cell wall; Pd: Plasmodesma图4蜜腺超微结构图Fig.4Ultrastructure of nectary径的蜜汁转运活动。3讨论蜜腺的表皮可见均匀分布的气孔,但未见蜜汁尊片、花瓣和蕊柱是建兰花部香气释放的分泌(图3-G、H)。这类气孔在地椒、刺五加、主要部位,释放的香气种类分别为14种、9种否、鹅掌柴等植物的腺体顶部也有广泛分布,相关和21种,其总含量分别为2116.46、898.08、研究者认为蜜汁一般由蜜腺表皮上的特殊气孔或角2269.49ng/(hg)[15-1]。蜜腺只检测到酯类物质一质层分泌[17,24-2]。有些植物的蜜腺具有特殊的组成种,是含量为17.10ng/(hg)的邻苯二甲酸二异丁结构,如亚比棉的蜜腺具有基细胞、柄细胞和亚腺酯,释香种类和含量明显低于上述部位,不是建兰组织,龙眼的蜜腺含有单细胞绒毛、亚腺细胞和花部的主要释香器官。油细胞。建兰蜜腺表皮具能够分泌花蜜的表皮本研究以建兰小桃红为材料,对建兰花部蜜腺毛,是建兰蜜腺的主要分泌结构,Cawoy等[2在养进行观察。建兰蜜腺的表面被角质膜覆盖,由1~2麦的蜜腺表皮也发现了类似结构。层表皮细胞和多层薄壁组织构成,这是较为常见的建兰蜜腺位于花托内子房3个心皮不完全愈合蜜腺结构[17-19]。蜜腺薄壁细胞组织中有大量空泡处的腔隙周围的表面,不是建兰的释香器官,但能内有团状贮藏物(图3-C、D),这类结构在刺五加够通过表皮毛分泌蜜汁。建兰蜜腺的泌蜜组织中存等植物中也有发现9,该结构是否与蜜汁分泌有关在团状烂藏物,可能是蜜汁前体物,建兰泌蜜细胞还需进一步研究。通过共质体途径转运成熟蜜汁至蜜腺表皮细胞。产蜜细胞内有大量内发达的线粒体和糙面内质网,并伴有大量质体和淀粉粒存在[19-21],但这类参考文献结构特征多发生于泌蜜前期的细胞内,是泌蜜细胞[1] Lin I W, Sosso D, Chen L Q, et al. Nectar secretion requires储存与转运蜜汁前体物质的必备条件。但本研究选sucrose phosphate synthases and the sugar transporter SWEET9[J]取盛开期的建兰作为试验材料,这一时期泌蜜细胞Nature,2014,508(7497):546-549的主要生理活动已经转为蜜汁分泌。建兰泌蜜细胞[2] Masicrowska M L Floral nectaries and nectar production in brown内细胞器退化,质体结构退化,呈空泡状,少量内mustard (Brassica juncea)and white mustard (Sincpis alba)质网在细胞边缘分布,这与刘林等[的研究结果(Brassicaceae)[JJ.Plant Syst Evol, 2003,238(1-4):97-107[3] Baum S F, Eshed Y, Bowman J L. The Arabidopsis niectary致。成熟花蜜通过质外体和共质体途径向蜜腺表皮细is an ABC-independent floral structure[]. Development, 2001,胞转运[2-2]。建兰泌蜜细胞中被染色较深的灰色嗜128(22):46574 667钱物质通过胞间连丝向蜜腺表皮细胞移动(图4-B),[4】柯贤港,蜜腺及其分类(四)[]蜜蜂杂志,1993(3):19-20这说明在建兰蜜腺中细胞通过共质体途径进行蜜汁[]郑红军。核果类果树樱桃、桃、查、李花外蜜腺观察研究[]分泌,但也不排除在建兰泌蜜组织中存在质外体途山东农业科学,2008(5):17-19?1994-2019ChinaAcademic JournalElectronicPublishingHouse.Allrightsreserved.http://www.cnki.net
第 6 期 3 讨论 萼 片 、 花 瓣 和 蕊 柱 是 建 兰 花 部 香 气 释 放 的 主 要 部 位, 释 放 的 香 气 种 类 分 别 为 14 种、 9 种 和 21 种 , 其 总 含 量 分 别 为 2 116.46、 898.08 、 2 269.49 ng/(h·g)[15-16]。 蜜 腺 只 检 测 到 酯 类 物 质 一 种, 是含量 为17.10 ng/(h·g)的邻苯二 甲酸二异丁 酯, 释香种类和含量明显低于上述部位, 不是建兰 花部的主要释香器官。 本研究以建兰小桃红为材料, 对建兰花部蜜腺 进行观察。 建兰蜜腺的表面被角质膜覆盖, 由 1~2 层表皮细胞和多层薄壁组织构成, 这是较为常见的 蜜腺结构[17-19]。 蜜腺薄壁细胞组织中有大 量空泡, 内有团状贮藏物(图 3-C、 D), 这类结构在刺五加 等植物中也有发现[19], 该结构是否与蜜汁分泌有关 还需进一步研究。 产蜜细胞内有大量内嵴发达的线粒体和糙面内 质网, 并伴有大量质体和淀粉粒存在[19-21], 但这类 结构特征多发生于泌蜜前期的细胞内, 是泌蜜细胞 储存与转运蜜汁前体物质的必备条件。 但本研究选 取盛开期的建兰作为试验材料, 这一时期泌蜜细胞 的主要生理活动已经转为蜜汁分泌。 建兰泌蜜细胞 内细胞器退化, 质体结构退化, 呈空泡状, 少量内 质网在细胞边缘分布, 这与刘林等[20]的研究结果一 致。 成熟花蜜通过质外体和共质体途径向蜜腺表皮细 胞转运[22-23]。 建兰泌蜜细胞中被染色较深的灰色嗜 锇物质通过胞间连丝向蜜腺表皮细胞移动(图 4-B), 这说明在建兰蜜腺中细胞通过共质体途径进行蜜汁 分泌, 但也不排除在建兰泌蜜组织中存在质外体途 径的蜜汁转运活动。 蜜腺的表皮可见均匀分布的气孔, 但未见蜜汁 分 泌 (图 3-G、 H)。 这 类 气 孔 在 地 椒、 刺 五 加、 杏、 鹅掌柴等植物的腺体顶部也有广泛分布, 相关 研究者认为蜜汁一般由蜜腺表皮上的特殊气孔或角 质层分泌[17,24-26]。 有些植物的蜜腺具有特殊的组成 结构, 如亚比棉的蜜腺具有基细胞、 柄细胞和亚腺 组织[27], 龙眼的蜜腺含有单细胞绒毛、 亚腺细胞和 油 细 胞[28]。 建 兰 蜜 腺 表 皮 具 能 够 分 泌 花 蜜 的 表 皮 毛, 是建兰蜜腺的主要分泌结构, Cawoy 等[29]在荞 麦的蜜腺表皮也发现了类似结构。 建兰蜜腺位于花托内子房 3 个心皮不完全愈合 处的腔隙周围的表面, 不是建兰的释香器官, 但能 够通过表皮毛分泌蜜汁。 建兰蜜腺的泌蜜组织中存 在团状贮藏物, 可能是蜜汁前体物, 建兰泌蜜细胞 通过共质体途径转运成熟蜜汁至蜜腺表皮细胞。 参考文献 [1] Lin I W, Sosso D, Chen L Q, et al. Nectar secretion requires sucrose phosphate synthases and the sugar transporter SWEET9[J]. Nature, 2014, 508(7 497): 546-549. [2] Masierowska M L. Floral nectaries and nectar production in brown mustard (Brassica juncea)and white mustard (Sinapis alba) (Brassicaceae)[J]. Plant Syst Evol, 2003, 238(1-4): 97-107. [3] Baum S F, Eshed Y, Bowman J L. The Arabidopsis nectary is an ABC-independent floral structure[J]. Development, 2001, 128(22): 4 657-4 667. [4] 柯贤港. 蜜腺及其分类(四)[J]. 蜜蜂杂志, 1993(3): 19-20. [5] 郑红军. 核果类果树樱桃、 桃、 杏、 李花外蜜腺观察研究[J]. 山东农业科学, 2008(5): 17-19. A~B: 透射电子显微镜照片, 示蜜腺薄壁组织细胞; N: 细胞核; W: 细胞壁; Pd: 胞间连丝。 A-B: Transmission electron microscopy (TEM), showing the parenchyma cells of nectary; N: Nucles; W: Cell wall; Pd: Plasmodesma. 图4 蜜腺超微结构图 Fig. 4 Ultrastructure of nectary A B 侯 佳等: 建兰蜜腺的显微结构及释香研究 1112- -

第39卷-1113-热带作物学报[6]程瑾,刘世勇,何荣,兔耳兰食源性欺骗传粉的研究[术研究中心,中国观赏园艺研究进展.杭州:中国园艺学会观生物多样性,2007,15(6):608-617赏园艺专业委员会2009年学术年会,2009:5.[7] Kjellson G, Rasmussen F N, Dupuy D. Pollination of Dendrobium[17]辛华,胡正海、地椒花蜜腺发育的解剖学观察[]植物资源infundibulum, Cymbidium insigne (Orchidaceae) and Rhododendron与环境学报,2000,9(1):43-46lyi(Ericaceae) by Bombus eximius (Apidae) in Thailand; a possible[18] Nepi M. Nectary structure and ultrastructure[My/Nicolson S W,case of floral mimicry) Joumal of Tropical Eology,1985,1(4):Nepi M, Pacini E. Nectaries and nectar.Dordrecht: Springer,289302.2007: 129166.[8] Davies K L, Stpiczynska M, Tumer M P. A rudimentary labella[19]王艳杰,刘林德,张丽,等。刺五加雌花蜜腺的显微形态和超微结构观察[西北植物学报,2009,29(12):2468-2475speculum in Cymbidium lowianum (Rchh. f.) Rchb. f.andCymbidium deronianm Paxton (Orchidaceae)) Ammals of Botany,[20] 刘林,赵小梅,杏花蜜腺的超微结构研究果树学报,2006,97:975-984.2011,28(5):792796.[9]刘可为,刘仲建,雷酮鹏,等,杏黄兜兰传粉生物学的研究[][21]舒金帅,刘玉梅,李占省,等。植物蜜腺研究进展及展望]深圳特区科技,2005,11(15):171-183.园艺学报,2014,41(9):1846-1860[10] Sasaki M,Ono M. Pollination ecology of the Japanese honeybee[22] Stpiczynska M, Davies K L, Gregg A. Nectary structure andand the oriental orchid[C]. Proceedings of the Ist intemationalnectar secretion in Maxllaria eoccinea (Jaceq) L.O. Willians exconference on the Asian honey bees and bee mites, Bangkok,Hodge (Orchidaceae)[]. Ann Bot, 2004, 93(1): 87-95.Thailand. Cheshire: Wicewas Press, 1993: 391-397.[23] Vassilyev A E. On the mechanisms of nectar secretion: revisited[].[1] Matila E, Kuttunen M T. Nutrient versus pollination limitationAnn Bot,2010,105(3):349-354in Platanthera bifolia and Dactylorhiza incarnate (Orchidaceae)[24] Zhu J, Hu Z, Muuml M. Ultrastructural investigations on floral[0ikos, 200, 89: 360-366.nectary of Arabidopsis thaliana prepared by high pressure freezing[12]庚晓红,罗毅波,董鸣春兰(兰科)传粉生物学的研究[and freeze substitutionJ]Biol Cell,1995,84(3):225植物分类学报,2008,46(2):163-174.[25]祝建,胡正海:拟南花蜜腺筛分子及蜜腺组织发育过程中[13] Du Puy D, Cribb P. The Genus CymbidiumM] London: Christopher的细胞学研究(英文)[Acta BotanicaSinica,2002(1):9-14Helm, 1988.[26]肖木珠,丁雨龙,鹅掌柴花蜜腺的发育解剖学研究西北植[14] Sasaki M, Ono M, Asada S, et d. Oriental orchid (Cymbidium物学报,2004,24(9):1727-1731.pumilum) atracts drones of the Japanese honeybee (Apis cerana[27]李露,张伯静。亚比棉蜜腺生物学性状研究[]中国生态农japonica) as pollinators[J]. Experientia, 1991, 47(11-12):业学报,2001,9(4):35-3812291 231.[28]崔大方,赵晟,黄盛丰。龙眼花蜜腺的发育解剖学研究[][15]杨慧君,姚娜,李璐滨,等。建兰花香成分的CC-MS分西北植物学报,2003,23(7):1188-1194析中国农学通报,2011(16):104-109[29] Cawoy V, Kinet J M, Jacquemart A L Morphology of nectaries佳,范燕萍。建兰花器官不同部位挥发性香气成分差异性[16]侯and biology of nectar production in the distylous species Fagopyrum分析CV/中国园艺学会观赏园艺专业委员会,国家花卉工程技esculentum[]. Annals of Botany, 2008, 102(5): 675-684.?1994-2019 China Academic JournalElectronic Publishing House.All rights reserved.http://www.cnki.net
热 带 作 物 学 报 第 39 卷 [6] 程 瑾, 刘世勇, 何 荣. 兔耳兰食源性欺骗传粉的研究[J]. 生物多样性, 2007, 15(6): 608-617. [7] Kjellsson G, Rasmussen F N, Dupuy D. Pollination of Dendrobium infundibulum, Cymbidium insigne (Orchidaceae) and Rhododendron lyi(Ericaceae) by Bombus eximius (Apidae) in Thailand: a possible case of floral mimicry[J]. Journal of Tropical Ecology, 1985,1(4): 289-302. [8] Davies K L, Stpiczynska M, Turner M P. A rudimentary labella speculum in Cymbidium lowianum (Rchb. f.) Rchb. f. and Cymbidium devonianum Paxton (Orchidaceae)[J]. Annals of Botany, 2006,97: 975-984. [9] 刘可为, 刘仲建, 雷嗣鹏, 等. 杏黄兜兰传粉生物学的研究[J]. 深圳特区科技, 2005, 11(15): 171-183. [10] Sasaki M,Ono M. Pollination ecology of the Japanese honeybee and the oriental orchid[C]. Proceedings of the 1st international conference on the Asian honey bees and bee mites, Bangkok, Thailand. Cheshire: Wicwas Press, 1993: 391-397. [11] Mattila E, Kuttunen M T. Nutrient versus pollination limitation in Platanthera bifolia and Dactylorhiza incarnate (Orchidaceae) [J]. Oikos, 2000, 89: 360-366. [12] 庾晓红, 罗毅波, 董 鸣. 春兰(兰科)传粉生 物 学 的 研 究[J]. 植物分类学报, 2008, 46(2): 163-174. [13] Du Puy D, Cribb P. The Genus Cymbidium[M]. London: Christopher Helm, 1988. [14] Sasaki M, Ono M, Asada S, et al. Oriental orchid (Cymbidium pumilum) attracts drones of the Japanese honeybee (Apis cerana japonica) as pollinators[J]. Experientia , 1991, 47 (11 -12): 1 229-1 231. [15] 杨 慧 君, 姚 娜, 李 潞 滨, 等. 建兰花香成分的 GC-MS 分 析[J]. 中国农学通报, 2011(16): 104-109. [16] 侯 佳, 范燕萍. 建兰花器官不同部位挥发性香气成分差异性 分析[C]//中国园艺学会观赏园艺专业委员会, 国家花卉工程技 术研究中心. 中国观赏园艺研究进展. 杭州: 中国园艺学会观 赏园艺专业委员会 2009 年学术年会, 2009: 5. [17] 辛 华, 胡正海. 地椒花蜜腺发育的解剖学观察[J]. 植物资源 与环境学报, 2000, 9(1): 43-46. [18] Nepi M. Nectary structure and ultrastructure[M]//Nicolson S W, Nepi M, Pacini E. Nectaries and nectar. Dordrecht: Springer, 2007: 129-166. [19] 王艳杰, 刘林德, 张 丽, 等. 刺五加雌花蜜腺的显微形态和超 微结构观察[J]. 西北植物学报, 2009, 29(12): 2 468-2 475. [20] 刘 林 , 赵 小 梅. 杏花蜜腺的超微结构研究[J]. 果 树 学 报 , 2011, 28(5): 792-796. [21] 舒金帅, 刘玉梅, 李占省, 等. 植物蜜腺研究进展及展望[J]. 园艺学报, 2014, 41(9): 1 846-1 860. [22] Stpiczynska M, Davies K L, Gregg A. Nectary structure and nectar secretion in Maxillaria coccinea (Jacq) L.O. Williams ex Hodge(Orchidaceae)[J]. Ann Bot, 2004, 93(1): 87-95. [23] Vassilyev A E. On the mechanisms of nectar secretion: revisited[J]. Ann Bot, 2010, 105(3): 349-354. [24] Zhu J, Hu Z, Muuml M. Ultrastructural investigations on floral nectary of Arabidopsis thaliana prepared by high pressure freezing and freeze substitution[J]. Biol Cell, 1995, 84(3): 225. [25] 祝 建, 胡正海. 拟南芥花蜜腺筛分子及蜜腺组织发育过程中 的细胞学研究(英文)[J]. Acta Botanica Sinica, 2002(1): 9-14. [26] 肖木珠, 丁雨龙. 鹅掌柴花蜜腺的发育解剖学研究[J]. 西北植 物学报, 2004, 24(9): 1 727-1 731. [27] 李 毳, 张伯静. 亚比棉蜜腺生物学性状研究[J]. 中国生态农 业学报, 2001, 9(4): 35-38. [28] 崔大方, 赵 晟, 黄盛丰. 龙眼花蜜腺的发育解剖学研究[J]. 西北植物学报, 2003, 23(7): 1 188-1 194. [29] Cawoy V, Kinet J M, Jacquemart A L. Morphology of nectaries and biology of nectar production in the distylous species Fagopyrum esculentum[J]. Annals of Botany, 2008, 102(5): 675-684. 1113- -
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《植物生物学》课程教学资源(文献资料)山西省轮藻植物新资料.pdf
- 《植物生物学》课程教学资源(文献资料)山西垣曲盆地始新世轮藻植物群.pdf
- 《植物生物学》课程教学资源(文献资料)内蒙古轮藻植物数量分类.pdf
- 《植物生物学》课程教学资源(文献资料)中国轮藻植物分布研究.pdf
- 《植物生物学》课程教学资源(文献资料)中国轮藻植物分布特点研究.pdf
- 《植物生物学》课程教学资源(文献资料)中国现生轮藻研究现状.pdf
- 《植物生物学》课程教学资源(文献资料)三种葫芦科植物花蜜腺的比较解剖学研究.pdf
- 《植物生物学》课程教学资源(文献资料)三尖杉类的化石及其起源初探.pdf
- 《植物生物学》课程教学资源(文献资料)CONVENTION ON BIOLOGICAL DIVERSITY.pdf
- 《植物生物学》课程教学资源(文献资料)Characteristics of Monocotyledonous Roots_Botany.pdf
- 《植物生物学》课程教学资源(文献资料)Top 3 Theories of Shoot Apical Meristem_Plants.pdf
- 《植物生物学》课程教学课件(讲稿)4 植物组织.pdf
- 《植物生物学》课程教学课件(讲稿)3 植物细胞2/2.pdf
- 《植物生物学》课程教学课件(讲稿)2 植物细胞1/2.pdf
- 《植物生物学》课程教学课件(讲稿)1 绪论.pdf
- 《植物生物学》课程教学资源(文献资料)花对称性的研究进展_李交昆.pdf
- 《植物生物学》课程教学资源(文献资料)国家重点保护野生植物名录_林业_中国政府网.pdf
- 《植物生物学》课程教学资源(文献资料)Wang2020_Article_InitiationAndMaintenanceOfPlan.pdf
- 《植物生物学》课程教学资源(文献资料)The Arabidopsis MERISTEM DISORGANIZATION 1 gene is.pdf
- 《植物生物学》课程教学资源(文献资料)Phylogenomics of the genus Populus reveals extensive interspecific gene flow.pdf
- 《植物生物学》课程教学资源(文献资料)植物微丝骨架的研究进展.pdf
- 《植物生物学》课程教学资源(文献资料)浅析轮藻植物与水体富营养化的关系.pdf
- 《植物生物学》课程教学资源(文献资料)獐茅盐腺形态结构及其泌盐性.pdf
- 《植物生物学》课程教学资源(文献资料)白三叶草花蜜腺的发育解剖学研究.pdf
- 《植物生物学》课程教学资源(文献资料)芭蕉科花蜜腺形态比较_兼论其与传粉者的关系.pdf
- 《植物生物学》课程教学资源(文献资料)荆条花内蜜腺的形态解剖学研究.pdf
- 《植物生物学》课程教学资源(文献资料)轮藻植物中某些矿质元素的测定.pdf
- 山东理工大学:《植物生物学》课程教学资源(实验指导)植物生物学实验简明教程(第六版).pdf
- 《植物生物学》课程教学资源(讲稿)第17次课 蕨类植物.pdf
- 《植物生物学》课程教学资源(讲稿)第18次课 裸子植物.pdf
- 《植物生物学》课程教学资源(讲稿)第19次课 被子植物 1/3.pdf
- 《植物生物学》课程教学资源(讲稿)第20次课 被子植物 2/3.pdf
- 《植物生物学》课程教学资源(讲稿)第21次课 被子植物 3/3.pdf
- 《植物生物学》课程教学课件(PPT讲稿)第10次课 叶的结构(二).ppt
- 《植物生物学》课程教学资源(讲稿)第11次课 繁殖和繁殖器官(二).pdf
- 《植物生物学》课程教学资源(讲稿)第12次课 繁殖和繁殖器官(三).pdf
- 《植物生物学》课程教学资源(讲稿)第13次课 繁殖和繁殖器官(四).pdf
- 《植物生物学》课程教学资源(讲稿)第14次课 繁殖和繁殖器官(五).pdf
- 《植物生物学》课程教学资源(讲稿)第15次课 藻类植物(1)第一节 藻类植物概述 第二节 蓝藻门 Cyanophyta 第三节 绿藻门(Chlorophyta).pdf
- 《植物生物学》课程教学资源(讲稿)第16次课 藻类植物(2)苔藓植物.pdf
